N2+3H2=2NH3; 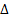 H<0;
H<0;
При увеличении CN2 или CH2 равновесие смещается вправо.
При увеличении СNH3 влево
При повышении давления вправо, т.е. в сторону веществ, занимающих меньший объем, т.к. это понизит давление.
При повышении температуры влево, т.е. в сторону эндотермической реакции, при которой происходит поглощение теплоты
Катализатор не влияет на смещение химического равновесия.
Принцип ЛеШателье применим к живым организмам.
Любая равновесная живая система при воздействии на нее перестраивается так, чтобы уменьшить это воздействие. Например, в основе внешнего дыхания человека лежит равновесие между гемоглобином HНв и оксигемоглобином HНвO2:. Венозная кровь поступает в легкие, где оказывается при повышенном давлении кислорода. В соответствии с принципом ЛеШателье
равновесие смещается вправо, в сторону HНвO2, и кровь насыщается кислородом. Артериальная кровь, поступающая в ткани, оказывается при пониженном парциальном давлении кислорода. Равновесие сдвигается влево, в сторону образования HНв, и кровь отдает кислород тканям.
7. Осмос- это односторонняя диффузия молекул растворителя в сторону более концентрированного раствора через полупроницаемые мембраны.
Осмотическое давление – это избыточное гидростатическое давление,
возникающее в результате осмоса.
Вант-Гофф (нидерландский физико-химик, 1887 г.) установил закон,
согласно которому осмотическое давление раствора равно тому давлению,
Которое производило бы растворенное вещество, если бы оно при той же
Температуре находилось в газообразном состоянии и занимало объем,
Равный объему раствора.
Р = СRТ; Р - осмотическое давление, Па атм. С - молярная концентрация вещества, моль/м3
моль/л R - универсальная газовая постоянная, 8,314Дж/ моль*К 0,082л*атм/моль*К
Т - абсолютная температура.
Молярная концентрация С подсчитывается по формуле:
n(в-ва) - количество вещества в моль,
m(в-ва) - масса вещества в г,
М(в-ва) - молярная масса вещества в г/моль,
V(р-ра) - объем раствора в л.
 2018-01-21
2018-01-21 803
803








