Закон действующих масс. В 1865 г. проф. H. H. Бекетов впервые высказал гипотезу о количественной взаимосвязи между массами реагентов и временем течения реакции: «...притяжение пропорционально произведению действующих масс». Эта гипотеза нашла подтверждение в законе действующих масс, который был установлен в 1867 двумя норвежскими химиками К.Гульдбергом и П. Вааге. Современная формулировка закона действующих масс такова: скорость гомогенной хим. реакции при постоянной температуре реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции: аА + b В ® mM + nN математическое выражение закона действующих масс имеет вид:
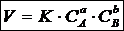 где V — скорость реакции; K — коэффициент пропорциональности, наз. константой скорости хим. реакции (при Ca= Cb= 1 моль/л Kчисленно равна V); Ca и Cb— концентрации реагентов А и В; а, Ь — стехиометрические коэфф. в уравнении реакции.
где V — скорость реакции; K — коэффициент пропорциональности, наз. константой скорости хим. реакции (при Ca= Cb= 1 моль/л Kчисленно равна V); Ca и Cb— концентрации реагентов А и В; а, Ь — стехиометрические коэфф. в уравнении реакции.
Константа V химической реакцииk определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции.
|
|
|
Кинетическим уравнением химической реакции называют математическую формулу, связывающую скорость реакции с концентрациями веществ. Это уравнение может быть установлено исключительно экспериментальным путём.В зависимости от механизма все химические реакции классифицируют на простые (элементарные) и сложные. Простыми называются реакции, протекающие в одну стадию за счёт одновременного столкновения молекул, записанных в левой части уравнения. В простой реакции могут участвовать одна, две или, что встречается крайне редко, три молекулы. Поэтому простые реакции классифицируют на мономолекулярные, бимолекулярные и тримолекулярные реакции. Так как с точки зрения теории вероятности одновременное столкновение четырёх и более молекул маловероятно, реакции более высокой, чем три, молекулярности не встречаются. Для простых реакций кинетические уравнения относительно просты. Например, для реакции H2 + I2 = 2 HI кинетическое уравнение имеет вид

= k ∙ C(I2) ∙ C(H2). Сложные реакции протекают в несколько стадий, причём все стадии связаны между собой. Поэтому кинетические уравнения сложных реакций более громоздки, чем простых реакций. Например, для сложной реакции H2 + Br2 = 2 HBr известно
 =
=  Сложность кинетического уравнения напрямую связана со сложностью механизма реакции.Основным законом химической кинетики является постулат, вытекающий из большого числа экспериментальных данных и выражающий зависимость скорости реакции от концентрации. Этот закон называют законом действующих масс.Он утверждает, что скорость химической реакции в каждый момент времени пропорциональна концентрациям реагирующих веществ, возведённым в некоторые степени.Если уравнение химической реакции имеет вид:aA + bB + dD→продукты,то формулу закона действующих масс можно представить в виде
Сложность кинетического уравнения напрямую связана со сложностью механизма реакции.Основным законом химической кинетики является постулат, вытекающий из большого числа экспериментальных данных и выражающий зависимость скорости реакции от концентрации. Этот закон называют законом действующих масс.Он утверждает, что скорость химической реакции в каждый момент времени пропорциональна концентрациям реагирующих веществ, возведённым в некоторые степени.Если уравнение химической реакции имеет вид:aA + bB + dD→продукты,то формулу закона действующих масс можно представить в виде  = k ∙
= k ∙  .В этом уравнении k – константа скорости химической реакции – важнейшая характеристика реакции, не зависящая от концентраций, а зависящая от температуры. Константа скорости химической реакции равна скорости реакции, если концентрации всех веществ равны 1 моль/л. Показатели степеней n1, n2, n3 называют частными порядками химической реакции по веществам А, В и D. Для простых реакций частные порядки – небольшие целые числа от нуля до трёх. Для сложных реакций частные порядки могут быть и дробными, и отрицательными числами. Сумма частных порядков называется порядком химической реакции n = n1+ n2+ n3. Таким образом, порядком химической реакции называют сумму показателей степеней концентраций в кинетическом уравнении.
.В этом уравнении k – константа скорости химической реакции – важнейшая характеристика реакции, не зависящая от концентраций, а зависящая от температуры. Константа скорости химической реакции равна скорости реакции, если концентрации всех веществ равны 1 моль/л. Показатели степеней n1, n2, n3 называют частными порядками химической реакции по веществам А, В и D. Для простых реакций частные порядки – небольшие целые числа от нуля до трёх. Для сложных реакций частные порядки могут быть и дробными, и отрицательными числами. Сумма частных порядков называется порядком химической реакции n = n1+ n2+ n3. Таким образом, порядком химической реакции называют сумму показателей степеней концентраций в кинетическом уравнении.
|
|
|
 2018-01-21
2018-01-21 4285
4285
