Энтропия – термод. ф-ция состояния системы и ее величина зависит от количества рассматриваемого вещества.  ,, W-термод. вероятность состояния системы;;
,, W-термод. вероятность состояния системы;; 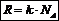 - -молярная газовая постоянная. Из уравнения следует, что энтропия системы увеличивается пропорционально логарифму термодинамической вероятности состояния W.Нетрудно понять, что энтропия возрастает при переходе жидкости в пар, при растворении кристаллического вещества, при расширении газов и т.д. Во всех этих случаях наблюдается уменьшение порядка в относительном расположении частиц. Наоборот, в процессах конденсации, кристаллизации веществ энтропия уменьшается.
- -молярная газовая постоянная. Из уравнения следует, что энтропия системы увеличивается пропорционально логарифму термодинамической вероятности состояния W.Нетрудно понять, что энтропия возрастает при переходе жидкости в пар, при растворении кристаллического вещества, при расширении газов и т.д. Во всех этих случаях наблюдается уменьшение порядка в относительном расположении частиц. Наоборот, в процессах конденсации, кристаллизации веществ энтропия уменьшается.
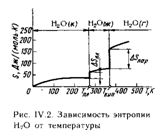 Представим себе один моль воды (18г Н2О) при комнатной температуре и атмосферном давлении. Пусть W(ж)- термоди-намическая вероятность состояния этой системы. При понижении температуры до 0 °С вода замерзает, превращается в лед; при этом молекулы Н2О как бы закрепляются в узлах кристаллической решетки и термодинамическая вероятность состояния системы уменьшается. W(к)<W(ж). Следовательно, падает и энтропия системы: S(к) <S(ж). Итак, при p=const энтропия является функцией температуры T, причем температура замерзания и температура кип. Н2О-это те точки, в кот.энтропия изменяется особенно резко. S=S2-S1-изменение энтропии.S2-сумма S всех продуктов реакции.S1-сумма S всех исходных веществ.
Представим себе один моль воды (18г Н2О) при комнатной температуре и атмосферном давлении. Пусть W(ж)- термоди-намическая вероятность состояния этой системы. При понижении температуры до 0 °С вода замерзает, превращается в лед; при этом молекулы Н2О как бы закрепляются в узлах кристаллической решетки и термодинамическая вероятность состояния системы уменьшается. W(к)<W(ж). Следовательно, падает и энтропия системы: S(к) <S(ж). Итак, при p=const энтропия является функцией температуры T, причем температура замерзания и температура кип. Н2О-это те точки, в кот.энтропия изменяется особенно резко. S=S2-S1-изменение энтропии.S2-сумма S всех продуктов реакции.S1-сумма S всех исходных веществ.
Химич. сродство определ, как способность веществ подвергаться химическим превращениям или химическому взаимодействию с образованием продуктов реакции.Вначале за меру химического сродства предлагали принимать скорость химической реакции. Однако скорость химической реакции при одних и тех же условиях можно было изменять путем воздействия на вещества катализаторами разной природы. Это приводило к неопределенности при определении химического сродства. Поэтому скорость химической I реакции не может быть мерой химического сродства.I Ю. Томсен (1853) и П. Бертло (1867) предложили за меру г химического сродства принимать тепловой э ффект хими ческой реакции, которая проходит самопроизвольного выделением теплоты (экзотермические процессы). Однако работами Д. И. Менделеева было показано, что этот принцип не обладает общностью. Дело в том, что, во-первых, некоторые реакции проходят самопроизвольно, но с поглощением энергии в форме теплоты при обычных температурах.Вовторых, все реакции являются обратимыми. Еще Бекетов показал, что одни и те же реакции при одних условиях проходят с выделением теплоты, а при других —с поглощением, как например, реакции гидрирования этилена.При обычных температурах эта реакция идет в прямом направлении с выделением теплоты, а при высоких температурах — в обратном направлении с поглощением теплоты. Следовательно, теплоту реакции также нельзя использовать при обычных условиях в качестве меры химического сродства.Правильное направление в определении меры химического сродства было намечено работами Дж. В. Гиббса и Г. Гельмгольца,который был развит Вант-Гоффом, который предложил в качестве меры химического сродства использовать максимальную работу химического процесса. Максимальная и максимально-полезная работы определяются по выражениям:
∆А=-Wи ∆G=-W’Эти величины являются интегральными и не зависят от способа проведения химического процесса, а зависят только от начального и конечного состояния системы. Учитывая, что ∆GT=∆HT-T∆ST,
Bеличина ∆GT будет равна тепловому эффекту реакции при T→0.Следовательно, сродство по Вант-Гоффу и Томсену—Бертло будут совпадать, если T∆ST =0 при Т=0, а ∆GT= ∆HT Для стандартных условий химическое сродство можно рассчитывать, по формуле:∆GT0=∆HT0-T∆ST0Стандартные условия характеризуют, что энергия Гиббса рассчитывается при давлении вещества в системе, равном Р= = 1 атм; 101,3 кПа; 1,013-105 Па.Знак изменения энергии Гиббса характеризует направление самопроизвольного или несамопроизвольного протекания процесса при данных условиях, а равенство (д ∆GT °)р,Т=0 определяет равновесное состояние в смеси химических веществ, между которыми возможно химическое взаимодействие. Равновесие имеет динамический характер, то есть при равновесии υпр= υобр.Химическое сродство можно рассчитывать по изменению энергии Гиббса, по изотермам, изохорам и изобарам химической реакции. С его помощью и закона действующих масс можно рассчитывать равновесный состав химического процесса.Стандартное химическое сродство 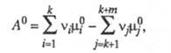 определяется соотношением:
определяется соотношением:
где 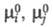 - стандартные хим. потенциалы соотв. реагентов и продуктов (см. стандартное состояние). Стандартное X. с. связано со стандартным изменением энергии Гиббса
- стандартные хим. потенциалы соотв. реагентов и продуктов (см. стандартное состояние). Стандартное X. с. связано со стандартным изменением энергии Гиббса 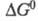 и константой равновесия р-ции К:
и константой равновесия р-ции К: 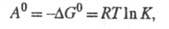
Энергия Гиббса хим. реакции. Энергия Гиббса G — термод. ф-ция сост. сист. (кДж/моль). Энергия Гиббса хим. р-циихар. направление и предел самопроизвольного протекания р-ции в условиях постоянства температуры и давления.
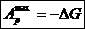
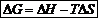
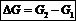 Стандартной энергией Гиббса образования хим. соединения ∆G0T, обр наз. энергию Гиббса реакции образ. одного моля этого соединения, находящегося в станд. сост., из соответствующих простых веществ, также наход. в станд. сост. и термод. устойчивых при данной температуре фазах и модификациях.
Стандартной энергией Гиббса образования хим. соединения ∆G0T, обр наз. энергию Гиббса реакции образ. одного моля этого соединения, находящегося в станд. сост., из соответствующих простых веществ, также наход. в станд. сост. и термод. устойчивых при данной температуре фазах и модификациях.
Направление химических реакций. При постоянных температуре и давлении реакция протекает самопроизвольно в том направлении, которому отвечает убыль энергии Гиббса системы (G2<G1). Поэтому условием самопроизвольного течения хим. реакции при заданных р и Т является неравенство ∆Gp,T< 0
Изобарно-изотермический потенциал. Принципиальная возможность или невозможность осуществления процесса. Энтальпийный и энтропийный факторы и направление процесса. Расчет направления протекания химических реакций.
Энергия Гиббса хим. реакции. (изобарно-изотерм.потенц)Энергия Гиббса G — термод. ф-ция сост. сист. (кДж/моль). Энергия Гиббса хим. р-циихар. напра вление и предел самопроизвольного протекания р-ции в условиях постоянства температуры и давления.
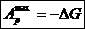
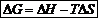
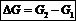 Стандартной энергией Гиббса образования хим. соединения ∆G0T, обр наз. энергию Гиббса реакции образ. одного моля этого соединения, находящегося в станд. сост., из соответствующих простых веществ, также наход. в станд. сост. и термод. устойчивых при данной температуре фазах и модификациях.
Стандартной энергией Гиббса образования хим. соединения ∆G0T, обр наз. энергию Гиббса реакции образ. одного моля этого соединения, находящегося в станд. сост., из соответствующих простых веществ, также наход. в станд. сост. и термод. устойчивых при данной температуре фазах и модификациях.
Энтальпийный и энтропийный факторы. Процессы могут протекать самопроизвольно (ΔG<0), если они сопровождаются уменьшением энтальпии (ΔH<0) и увеличением энтропии системы (ΔS>0). Если же энтальпия системы увеличивается (ΔH>0), а энтропия уменьшается (ΔS<0), то такой процесс протекать не может (ΔG>0). При иных знаках ΔSи ΔН принципиальная возможность протекания процесса определяется соотношением энтальпийного (ΔH) и энтропийного (ТΔS) факторов.
Если ΔН>0 и ΔS>0, т.е. энтальпийная составляющая противодействует, а энтропийная благоприятствует протеканию процесса, то реакция может протекать самопроизвольно за счет энтропийной составляющей, при условии, что |ΔH|<|TΔS|.
Если, энтальпийная составляющая благоприятствует, а энтропийная противодействует протеканию процесса, то реакция может протекать самопроизвольно за счет энтальпийной составляющей, при условии, что |ΔH|>|TΔS|.
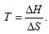 Влияние температуры на направление реакции. Изменение знака энергии Гиббса произойдет при.Очевидно, что смена знака энергии Гиббса с изменением температуры возможна только в двух случаях: 1) ΔН>0 и ΔS>0 и 2) ΔН<0 и ΔS<0.
Влияние температуры на направление реакции. Изменение знака энергии Гиббса произойдет при.Очевидно, что смена знака энергии Гиббса с изменением температуры возможна только в двух случаях: 1) ΔН>0 и ΔS>0 и 2) ΔН<0 и ΔS<0.
В химических процессах одновременно действуют две тенденции: стремление частиц объединиться за счет прочных связей в более сложные, что уменьшает энтальпию системы, и стремление частиц разъединяться, что увеличивает энтропию. Иными словами, проявляется действие двух прямо противоположных факторов – энтальпийного (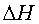 ) и энтропийного (Т·
) и энтропийного (Т· 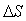 ). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса DG (или изобарно–изотермического потенциала):
). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса DG (или изобарно–изотермического потенциала):
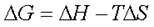 . Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности являются неравенство:
. Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности являются неравенство:
 (услов.самопроизвольности).Иными словами, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше,чемвконечном.Увеличение энергии Гиббса (
(услов.самопроизвольности).Иными словами, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше,чемвконечном.Увеличение энергии Гиббса (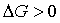 ) свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
) свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
Если же 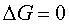 , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
В соответствии с уравнением  самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтроп.системы,тоестькогда
самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтроп.системы,тоестькогда 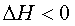 и
и 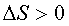 . При других сочетаниях
. При других сочетаниях 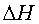 и
и 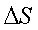 возможность процесса определяют либо энтальпийный, либо энтропийный фактор.
возможность процесса определяют либо энтальпийный, либо энтропийный фактор.
 2018-01-21
2018-01-21 2088
2088
