Периодичность - это повторяемость свойств хим. и некоторых физич.св-в у простых вещ-в и их соединений при изменении порядкового номера элементов. Она связанас повторяемостью электронного строения атомов по мере увеличения порядкового номера (а, следовательно, заряда ядра и числа электронов в атоме).Химпериодичность проявляется в аналогии химического поведения, однотипности химических реакций. При этом число валентных электронов, характерные степени окисления, формулы соединений могут быть разными. Периодически повторяются не только сходные черты, но и существенные различия химических свойств элементов по мере роста их порядкового номера. Некоторые физико-химические свойства атомов (потенциал ионизации, атомный радиус), простых и сложных веществ могут быть не только качественно, но и количественно представлены в виде зависимостей от порядкового номера элемента, причем для них периодически проявляются четко выраженные максимумы и минимумы. Вертикальная период. заключается в повторяемости свойств простых веществ и соединений в вертикальных столбцах Периодической системы. Это основной вид периодичности, в соответствии с которым все элементы объединены в группы. Элементы одной группы имеет однотипные электронные конфигурации. Химия элементов и их соединений обычно рассматривается на основе этого вида периодичности. Вертикальная периодичность обнаруживается и в некоторых физических свойствах атомов, например, в энергиях ионизации Ei (кДж/моль): IA-гр: Li 520, Na 490, K 420. IIA-гр: Be 900, Mg 740, Ca 590. VIIIA-гр: Ne 2080, Ar 1520, Ar 1520.
Горизонтальная период. заключается в появлении макс и мин значсв-в простых веществ и соединений в пределах каждого периода. Она особенно заметна для элементов VIIIБ-группы и лантаноидов (например, лантаноиды с четными порядковыми номерами более распространены, чем с нечетными).В таких физических свойствах, как энергия ионизации и сродство к электрону, также проявляется горизонтальная периодичность, связанная с периодическим изменением числа электронов на последних энергетических подуровнях:
| Элемент | Li | Be | B | C | N | O | F | Ne |
| Ei | ||||||||
| Ae | −60 | −27 | −122 | +7 | −141 | −328 | ||
| Электронная фор-ла (валент.эл-ны) | 2 s 1 | 2 s 2 | 2 s 22 p 1 | 2 s 22 p 2 | 2 s 22 p 3 | 2 s 22 p 4 | 2 s 22 p 5 | 2 s 22 p 6 |
Диагонал.период - повторяемость свойств простых веществ и соединений по диагоналям Периодической системы. Она связана с возрастание неметаллических свойств в периодах слева направо и в группах снизу вверх. Поэтому литий похож на магний, бериллий на алюминий, бор на кремний, углерод на фосфор. Так, литий и магний образуют много алкильных и арильных соединений, которые часто используют в органической химии. Бериллий и алюминий имеют сходные значения окислительно-восстановительных потенциалов. Бор и кремний образуют летучие, весьма реакционноспособные молекулярные гидриды.Диагональную периодичность не следует понимать как абсолютное сходства атомных, молекулярных, термодинамических и других свойств. Та, в своих соединениях атом лития имеет степень окисления (+I), а атом магния - (+II). Однако свойства ионов Li+ и Mg2+ очень близки, проявляясь, в частности, в малой растворимости карбонатов и ортофосфатов. В результате объединения вертикальной, горизонтальной и  диагональной периодичности появляется так называемая звездная периодичность. Так, свойства германия напоминают свойства окружающих его галлия, кремния, мышьяка и олова. На основании таких "геохимических звезд" можно предсказать присутствие элемента в минералах и рудах. Вторичнаяпериодич. Многие свойства элементов в группах изменяются не монотонно, а периодически, особенно для элементов IIIA-VIIA-групп. Такое явление носит название вторичной периодичности. Так, германий по своим свойствам больше похож на углерод, чем на кремний. Известно, что силан реагирует с гидроксид-ионами в водном растворе с выделением водорода, а метан и герман не взаимодействуют даже с избытком гидроксид-ионов.Подобные аномалии в химическом поведении элементов наблюдаются и в других группах. Так, например, для элементов 4-го периода, находящихся в VA-VIIA-группах, (As, Se, Br) характерна малая устойчивость соединений в высшей степени окисления. В то время как для фосфора и сурьмы известныпентафториды, пентахлориды и пентаиодиды, в случае мышьяка до сих получен только пентафторид. Гексафторид селена менее устойчив, чем соответствующие фториды серы и теллура. В группе галогенов хлор(VII) и иод(VII) образуют устойчивые кислородсодержание анионы, тогда как пербромат-ион, синтезированный лишь в 1968 г., является очень сильным окислителем.Вторичная периодичность связана, в частности, с относительной инертностью валентных s-электронов за счет так называемого "проникновения к ядру", поскольку увеличение электронной плотности вблизи ядра при одном и том же главном квантовом числе уменьшается в последовательности ns>np>nd>nf.Поэтому элементы, которые в Периодической системе стоят непосредственно после элементов со впервые заполненным p-, d- или f-подуровнем, характеризуются понижением устойчивости их соединений в высшей степени окисления. Это натрий и магний (идут после элементов с впервые заполненным р-подуровнем), р-элементы 4-го периода от галлия до криптона (заполнен d-подуровень), а также послелантаноидные элементы от гафния до радона. Периодичность атомных и ионных R. Для групп непероходных элементов атомные и ионные радиусы увеличиваются с увеличением порядкового номера (Z). Наибольшее увеличение имеет место для двух наиболее легких членов группы (Li и Be) и наименьшее для двух наиболее тяжелых членов группы. Но при изменении атомных и ионных радиусов по периодам они в общем уменьшаются при увеличении заряда ядра (Z). Наибольшее уменьшение наблюдается у элементов малых периодов, т.к. у них происходит заполнение внешнего электронного слоя. В больших периодах в пределах семейств d- и f- элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называют соответственно d и f сжатием, (т.к. эти элементы имеют электроны, обладающие малой экранирующей способностью). Атомный радиус — это радиус сферы, внутри которой заключено ядро атома и 95% плотности всего электронного облака, окружающего ядро. Это условное понятие, т.к. электронное облако атома не имеет четкой границы, оно позволяет судить о размерах атома. Численные значения атомных радиусов разных химических элементов находят экспериментально, анализируя длины химических связей, т.е. расстояния между ядрами связанных между собой атомов. Радиусы атомов выражают обычно в нанометрах (нм), 1 нм = 10–9 м, пикометрах (пм), 1 пм = 10–12 м или ангстремах (A), 1 A = 10–10 м. Ат-ые радразделяют на металлические, которые мы находим в металлах, сплавах или интерметаллических соед-ях, и ковалентные, характерные для неметаллов и вообще для ковалентных молекул.Ковалентные радиусы подразделяют на тетраэдрические, октаэдрические и т.д.,нужно различать радиусы при одинарной, двойной и тройной связях. За ковалентный радиус атома при одинарной связи принимают половину расстояния между ядрами 2х одинаковых атомов, связанных ковалентной связью.Существуют ещё атомные радиусы по Брэггу–Слейтеру и орбитальные радиусы.Ван-дер-ваальсовы радиусы следует рассматривать как радиусы несвязанных атомов. Их находят по межатомным расстояниям в твердом теле или жидкости, где атомы находятся в непосредственной близости друг от друга, но не связаны между собой ионной, ковалентной или металлической связью. Иoнныйрадиус. Радиусы ионов отличаются от атомных радиусов соответствующих элементов. Потеря атомами электронов приводит к уменьшению их эффективных размеров, а пpисоединение избыточных электронов — к увеличению. Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома. Так, радиус атома калия составляет 0,236 нм, а радиус иона K+ — 0,133 нм; радиусы атома хлора и хлорид-ионаСl– соответственно равны 0,099 и 0,181 нм. При этом радиус иона тем сильней отличается от радиуса атома, чем больше заряд иона. Например, радиусы атома хрома и ионов Cr2+ и Cr3+ составляют соответственно 0,127, 0,083 и 0,064 нм Атомные радиусы нужно применять в том случае, когда атомы соединены ковалентной или металлической связью. Это связывание осуществляется, если атомы приближаются друг к другу на расстояние, когда каждый атомный радиус примерно равен радиусу максимума радиальной плотности заряда.Ионные радиусы используются в том случае, когда внешний электрон полностью удален с внешней орбитали электроотрицательного атома.
диагональной периодичности появляется так называемая звездная периодичность. Так, свойства германия напоминают свойства окружающих его галлия, кремния, мышьяка и олова. На основании таких "геохимических звезд" можно предсказать присутствие элемента в минералах и рудах. Вторичнаяпериодич. Многие свойства элементов в группах изменяются не монотонно, а периодически, особенно для элементов IIIA-VIIA-групп. Такое явление носит название вторичной периодичности. Так, германий по своим свойствам больше похож на углерод, чем на кремний. Известно, что силан реагирует с гидроксид-ионами в водном растворе с выделением водорода, а метан и герман не взаимодействуют даже с избытком гидроксид-ионов.Подобные аномалии в химическом поведении элементов наблюдаются и в других группах. Так, например, для элементов 4-го периода, находящихся в VA-VIIA-группах, (As, Se, Br) характерна малая устойчивость соединений в высшей степени окисления. В то время как для фосфора и сурьмы известныпентафториды, пентахлориды и пентаиодиды, в случае мышьяка до сих получен только пентафторид. Гексафторид селена менее устойчив, чем соответствующие фториды серы и теллура. В группе галогенов хлор(VII) и иод(VII) образуют устойчивые кислородсодержание анионы, тогда как пербромат-ион, синтезированный лишь в 1968 г., является очень сильным окислителем.Вторичная периодичность связана, в частности, с относительной инертностью валентных s-электронов за счет так называемого "проникновения к ядру", поскольку увеличение электронной плотности вблизи ядра при одном и том же главном квантовом числе уменьшается в последовательности ns>np>nd>nf.Поэтому элементы, которые в Периодической системе стоят непосредственно после элементов со впервые заполненным p-, d- или f-подуровнем, характеризуются понижением устойчивости их соединений в высшей степени окисления. Это натрий и магний (идут после элементов с впервые заполненным р-подуровнем), р-элементы 4-го периода от галлия до криптона (заполнен d-подуровень), а также послелантаноидные элементы от гафния до радона. Периодичность атомных и ионных R. Для групп непероходных элементов атомные и ионные радиусы увеличиваются с увеличением порядкового номера (Z). Наибольшее увеличение имеет место для двух наиболее легких членов группы (Li и Be) и наименьшее для двух наиболее тяжелых членов группы. Но при изменении атомных и ионных радиусов по периодам они в общем уменьшаются при увеличении заряда ядра (Z). Наибольшее уменьшение наблюдается у элементов малых периодов, т.к. у них происходит заполнение внешнего электронного слоя. В больших периодах в пределах семейств d- и f- элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называют соответственно d и f сжатием, (т.к. эти элементы имеют электроны, обладающие малой экранирующей способностью). Атомный радиус — это радиус сферы, внутри которой заключено ядро атома и 95% плотности всего электронного облака, окружающего ядро. Это условное понятие, т.к. электронное облако атома не имеет четкой границы, оно позволяет судить о размерах атома. Численные значения атомных радиусов разных химических элементов находят экспериментально, анализируя длины химических связей, т.е. расстояния между ядрами связанных между собой атомов. Радиусы атомов выражают обычно в нанометрах (нм), 1 нм = 10–9 м, пикометрах (пм), 1 пм = 10–12 м или ангстремах (A), 1 A = 10–10 м. Ат-ые радразделяют на металлические, которые мы находим в металлах, сплавах или интерметаллических соед-ях, и ковалентные, характерные для неметаллов и вообще для ковалентных молекул.Ковалентные радиусы подразделяют на тетраэдрические, октаэдрические и т.д.,нужно различать радиусы при одинарной, двойной и тройной связях. За ковалентный радиус атома при одинарной связи принимают половину расстояния между ядрами 2х одинаковых атомов, связанных ковалентной связью.Существуют ещё атомные радиусы по Брэггу–Слейтеру и орбитальные радиусы.Ван-дер-ваальсовы радиусы следует рассматривать как радиусы несвязанных атомов. Их находят по межатомным расстояниям в твердом теле или жидкости, где атомы находятся в непосредственной близости друг от друга, но не связаны между собой ионной, ковалентной или металлической связью. Иoнныйрадиус. Радиусы ионов отличаются от атомных радиусов соответствующих элементов. Потеря атомами электронов приводит к уменьшению их эффективных размеров, а пpисоединение избыточных электронов — к увеличению. Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома. Так, радиус атома калия составляет 0,236 нм, а радиус иона K+ — 0,133 нм; радиусы атома хлора и хлорид-ионаСl– соответственно равны 0,099 и 0,181 нм. При этом радиус иона тем сильней отличается от радиуса атома, чем больше заряд иона. Например, радиусы атома хрома и ионов Cr2+ и Cr3+ составляют соответственно 0,127, 0,083 и 0,064 нм Атомные радиусы нужно применять в том случае, когда атомы соединены ковалентной или металлической связью. Это связывание осуществляется, если атомы приближаются друг к другу на расстояние, когда каждый атомный радиус примерно равен радиусу максимума радиальной плотности заряда.Ионные радиусы используются в том случае, когда внешний электрон полностью удален с внешней орбитали электроотрицательного атома.
10. Химическая связь. Основные типы и характеристики химической связи. Условия и механизм ее образования. Энергия связи. Хим св. -взаимод.двух или нескольких атомов,приводящее к образованию устойчивой многоатомной сист,харак-ся перестройкой электронных оболочек связывающихся атомов. Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную. Ковалентная химсв — это связь, возникающая между атомами за счет образования общих электронных пар.Хар-ой особенностью ковал.св.явл-ся её насыщенность и направленность,прочность.По механизму образования и ориентации общего эл облака различают: ковал.полярную (образ.между двумя разными по электроотрицатомами.Общееэл.облако смещено в сторону наиболее электроотриц.эл.) и ковал.неполярную (образуется в результ двух одинаковых по электроотрицательностиатомов.Общее эл облако расположено симметрично в пространстве между ядрами.двухат.мол-л:H2,O2,Cl2..По числу общих эл.паропред.валентность эл.),а так же разновидностью ковал.св.явл-ся донорно-акцепторная св(образ.в том случае,еслисущ-ет атом с неподелённой парой эл-ов на внешнем эл.слое и атом,у которого имеется свободная орбиталь.Атом или ион,поставляющий пару эл-донор,а принимающий эту пару на свою свободную орбиталь-акцептором.Ионная-св,в основе которой лежит электростатическое взаимод противоположно заряженных ионов. Ионнаясв. образуется только между металлом и неметаллом.Хар-ыепризнаки:ненасыщаемость,ненаправленность.Водороднаясв-способность атома водорода соедин с атомом сильно электроотриц элемента к образованию ещё одной химсв с др подобным атомом. Водор.св обознач в виде точек.Условием возникновения водорсвявл-ся большая величина электроотриц,непосредственно связанного с водородом.Это объясняется тем,что после отдачи единственного эл водород приобретает сравнительно высокий полож.заряд.Врезульт этого атом водор одной мл-лы связывается неподелённойэлектр парой атома электроотриц элемента др молекулы. Металическая связь - это связь в металлах между атомами и ионами, образованная за счет обобществления электронов.металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве. Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи. Энергия связи — энергия, необходимая для разрыва химсв во всех молекулах, составляющих один моль вещ. Энергии ковалентных и ионных связей обычно велики и составляют величины порядка 100-800 кДж/моль.Главным условием образования химсвявл-ся уменьшение потенциальной энергии взаимодействующих атомов.
11.Ковалентная связь, ее основные характеристики. Примеры химических соединений, в которых присутствует ковалентная связь. Ковалентная химсв — это связь, возникающая между атомами за счет образования общих электронных пар. Хар-ой особенностью ковал.св.явл-ся её:1.насыщенность (это способность атома участвовать только в определенном числе КС, насыщаемость характеризует валентностью атома. Количественные меры валентности явл. число не спаренных электронов у атома в основном и в возбужденном состоянии.), Направленность КС. Наиболее прочные КС образуются в направлении максимального перекрывания атомных орбиталей, т.е. мерой направленности служит валентный угол. 3.Прочность КС – это свойства характер.длинной связи (межъядерное пространство) и энергии энергией связи.4. Гибридизация КС – при гибридизации происходит смещение атомных орбиталей, т.е. происходит выравнивание по энергии и по форме. Существует sp, sp2, sp3 –гибридизация. sp – форма молекулы линейная (угол 1800), sp2 – форма молекулы плоская треугольная (угол 1200), sp3 - форма тетраэдрическая (угол 109028).5По механизму образования и ориентации общего эл облака различают:ковал. полярную (образ.между двумя разными по электроотрицатомами.Общееэл.облако смещено в сторону наиболее электроотриц.эл. H2O,HCL,CO2,NH3) и ковал. неполярную( образуется в результ двух одинаковых по электроотрицательностиатомов.Общее эл облако расположено симметрично в пространстве между ядрами.двухат.мол-л:H2,O2,Cl2..По числу общих эл.паропред.валентность эл.),а так же разновидностью ковал.св.явл-ся донорно-акцепторная св(образ.в том случае,еслисущ-ет атом с неподелённой парой эл-ов на внешнем эл.слое и атом,у которого имеется свободная орбиталь.Атом или ион,поставляющий пару эл-донор,а принимающий эту пару на свою свободную орбиталь-акцептором.(NH3,NH4)
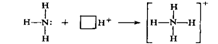
 12.Донорно-акцепторная связь, ее основные характеристики. Примеры соединений, в которых эта связь присутствует. Понятие о комплексных соединениях. Механизм возникновения ковалентных связей путем обобществления неспаренных электронов двух атомов получил название обменного механизма.( А*+В*=А:В). разновидностью ковал.св.явл-ся донорно-акцепторная св(образ.в том случае,еслисущ-ет атом с неподелённой парой эл-ов на внешнем эл.слое и атом,у которого имеется свободная орбиталь(А:(донор)+В=А[:]В).Атом или ион,поставляющий пару эл-донор,а принимающий эту пару на свою свободную орбиталь-акцептором.(NH3,NH4). Согласно методу, ковалентная связь по дон-акц механизму возникает при перекрывании вакантной орбитали акцептора с заполненнымиорбиталями донора или донорной группы. Поэтому донорная группа должна содержать по меньшей мере одну не поделенную пару электронов. Пример: образование хим связи по дон-акц механизму при взаим. молекулы аммиака с ионом водорода. Атом азота имеет на внешнем энерг. уровне два спаренных и три не спаренных электрона:В молекуле аммиака не спаренные 2р-электроны атома азота образуют три электронные пары с электронами атомов водорода. У атома азота остается не поделенная пара электронов 2s2 т. е. два электрона с антипаралелльными спинами на одной атомнойорбитали. Не поделенная пара электронов становится общей для атомов азота и водорода, возникает хим. связь по дон-акц механизму. Атом азота молекулы аммиака является донором, а ион водорода—акцептором. Можно представитьобраз. иона аммония схемой:.
12.Донорно-акцепторная связь, ее основные характеристики. Примеры соединений, в которых эта связь присутствует. Понятие о комплексных соединениях. Механизм возникновения ковалентных связей путем обобществления неспаренных электронов двух атомов получил название обменного механизма.( А*+В*=А:В). разновидностью ковал.св.явл-ся донорно-акцепторная св(образ.в том случае,еслисущ-ет атом с неподелённой парой эл-ов на внешнем эл.слое и атом,у которого имеется свободная орбиталь(А:(донор)+В=А[:]В).Атом или ион,поставляющий пару эл-донор,а принимающий эту пару на свою свободную орбиталь-акцептором.(NH3,NH4). Согласно методу, ковалентная связь по дон-акц механизму возникает при перекрывании вакантной орбитали акцептора с заполненнымиорбиталями донора или донорной группы. Поэтому донорная группа должна содержать по меньшей мере одну не поделенную пару электронов. Пример: образование хим связи по дон-акц механизму при взаим. молекулы аммиака с ионом водорода. Атом азота имеет на внешнем энерг. уровне два спаренных и три не спаренных электрона:В молекуле аммиака не спаренные 2р-электроны атома азота образуют три электронные пары с электронами атомов водорода. У атома азота остается не поделенная пара электронов 2s2 т. е. два электрона с антипаралелльными спинами на одной атомнойорбитали. Не поделенная пара электронов становится общей для атомов азота и водорода, возникает хим. связь по дон-акц механизму. Атом азота молекулы аммиака является донором, а ион водорода—акцептором. Можно представитьобраз. иона аммония схемой:.
Комплексные соединения – соединения в которых действуют одна или несколько дон-акц связей. В комплексном соед различают внут и внеш сферу. Внут сфера заключается в скобки и состоит из комплексообразователя и лигандов. Комплексообразователь – центральный атом или ион явл акцептором электронов. Лиганды – ионы или молекулы связ с комплексообразователем дон-акц связью явл донорами электронов. Различают катионные, анионные и нейтральные комплексы. Координационное число – кол-во лигандовприсоед к комплексообразователю (от 1 до 12). Заряд комплексного иона – равен сумме зарядов комплексообразователя и лигандов. Пример: К3[Fe(CN)6], [Co(NH3)6]Cl3.
13. Ионная связь, ее основные характеристики. Примеры соединений, в которых эта связь присутствует. Ионная-св,в основе которой лежит электростатическое взаимод противоположно заряженных ионов.Ионнаясв.образуется только между металлом и неметаллом.Хар-ыепризнаки:ненасыщаемость,ненаправленность. Такой тип связи возможен только между атомами элементов, электроотрицательности которых значительно отличаются. При этом происходит переход электрона от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью.такой тип химической связи образуется между атомами металлов и неметаллов. Например, элементы первой и второй группы главных подгрупп периодической системы (типичные металлы) непосредственно соединяются с элементами шестой и седьмой группы главных подгрупп периодической системы (типичные неметаллы).Ионная связь является крайним случаем ковалентной полярной связи. Соединения с ионной связью называют ионными. Как примеры веществ с ионным типом связи можно назвать магний сульфид MgS, алюминий хлорид AlCl3, натрий бромид NaBr. NaCl, CsF.Ионная связь также существует в солях кислородсодержащие кислот и в лугах между атомамВ отличие от ковалентной связи, -ионная связь не обладает на-правленностью. Это объясняется тем, что эл поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами осуществляется одинаково независимо от направления. Система из двух зарядов, одинаковых по абсолютной величине, но противоположных по знаку, создает в окружающем пространстве электрическое поле. Это означает, что два разноименных иона, притянувшиеся друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами. В этом состоит еще одно различие между ионным и ковалентным типами связи: ионная связь не обладает насыщаемостью. Поэтому к данному иону может присоединиться различное число ионов противоположного знака. Это число определяется относительными размерами взаимодействующих ионов, а также тем, что силы притяжения разноименно заряженных ионов должны преобладать над силами взаимного отталкивания, действующими между ионами одногознака.Отсутствие у ионной связи направленности и насыщаемости обусловливает склонность ионных молекул к ассоциации, т. е. к соединению их друг с другом. При высоких температурах кине-тическая энергия движения молекул преобладает над энергией их взаимного притяжения: поэтому в газообразном состоянии ионные соединения существуют в основном в виде неассоциированных молекул. Все ионные соединения в твердом состоянии имеют не молекулярную, а ионную кристаллическую решетку.
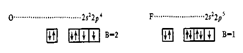
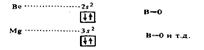 14. Метод валентных связей. Валентность. Метод валентных связей. (м. в. с.) В основу м. в. с. лежит исследования англ-их учёных Гейтлера и Лондона. Их исследования проводились на атоме Н.Образовалась общая электронная пара, ¡ принадлежит обоим ато-мам.В основе м. в. с. лежат следующие положе-ния: 1. ковалентная хим-ая связь образуется 2 электронами, с противоположенно направленными спинами. 2. ковалентная связь тем плонтее, чем в большей степени происходит перекрытие электронных облаков.
14. Метод валентных связей. Валентность. Метод валентных связей. (м. в. с.) В основу м. в. с. лежит исследования англ-их учёных Гейтлера и Лондона. Их исследования проводились на атоме Н.Образовалась общая электронная пара, ¡ принадлежит обоим ато-мам.В основе м. в. с. лежат следующие положе-ния: 1. ковалентная хим-ая связь образуется 2 электронами, с противоположенно направленными спинами. 2. ковалентная связь тем плонтее, чем в большей степени происходит перекрытие электронных облаков.
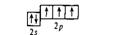
Валентность. Связь между валентностью эл. и его положением в периодической системе была установлена Менделеевым. Он же ввел понятие о переменной валентности. Валентность — сложное понятие. Поэтому существует несколько определений валентности, выражающих различные стороны этого понятия. Наиболее общим можно считать следующее определение: валентность эл. - это способность его атомов соединяться с другими атомами в определенных соотношениях. В образовании химических связей принимают участие не спаренные т.е. холостые эл. атома, находящиеся в основном или невозбужденном состоянии. Процесс перехода возможен если у атома имеются: спаренный электрон и свободная атомная орбиталь.
У большинства элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H2S), а по кислороду шести (SO3). Например, углерод образует с кислородом два оксида: монооксид углерода СО и диоксид углерода CO2. В монооксиде углерода валентность углерода равна двум, а в диоксиде — четырем. Кроме валентности по водороду и по кислороду, способность атомов данного элемента соединяться друг с другом или с атомами других элементов можно выразить иными способами: например, числом химических связей, образуемых атомом данного элемента (ковалентность), или числом атомов, непосредственно окружающих данный атом (координационное число). Таким образом, эквивалентная масса элемента равна мольноймассе его атомов, деленной на валентность элемента в данном соединении. Валентность, определяемая последним соотношением, называется стехиометрической валентностью элемента.
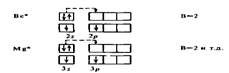
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем уровне нет неспаренных электронов:
При возбуждении этих атомов спаренные s-электроны разъе-диняются в свободные ячейки р-подуровня этого же уровня и валентность становится равной двум (возбужденный атом отмечен звездочкой):
Кислород и фтор во всех соединениях проявляют постоянную валентность, равную двум для кислорода и единице для фтора. Валентные электроны этих элементов находятся на втором энергетическом уровне, где нет более свободных ячеек:
15.Межмолекулярное взаимодействие. Ван-дер-Ваальсовы силы. Типы межмолекулярного взаимодействия (ориентационное, индукционное и дисперсионное). Влияние сил межмолекулярного взаимодействия на свойства веществ. Межмолекулярные взаимодействия, взаимодействия молекул между собой, не приводящее к разрыву или образованию новых химических связей. Межмолекулярные взаимодействия определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От межмолекулярных взаимодействий зависят многие структурные, спектральные, термодинамические, теплофизические и другие свойства веществ. Появление понятия межмолекулярные взаимодействия связано с именем Й. Д. Ван-дер-Ваальса, который для объяснения свойств реальных газов и жидкостей предложил в 1873 уравнение состояния, учитывающее межмолекулярные взаимодействия. Поэтому силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми.Виды межмолекулярных взаимодействий Основу межмолекулярных взаимодействий составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых свойствах вещества проявляется усредненное взаимодействие, которое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физических характеристик (дипольного момента, поляризуемости и др.). При больших R, значительно превосходящих линейные размеры l самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы межмолекулярного взаимодействия можно достаточно обоснованно подразделить на три вида - электростатические, поляризационные (индукционные) и дисперсионные. Электростатические силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризационными силами, если молекулы анизотропны.При малых расстояниях между молекулами (R ~ l) различать отдельные виды межмолекулярных взаимодействий можно лишь приближенно, при этом, помимо названных трех видов, выделяют еще два, связанные с перекрыванием электронных оболочек, - обменное взаимодействие и взаимодействия, обязанные переносу электронного заряда. Несмотря на некоторую условность, такое деление в каждом конкретном случае позволяет объяснять природу межмолекулярного взаимодействия и рассчитать его энергию.
 2018-01-21
2018-01-21 1750
1750








