Основной (фактически единственной) функцией кислорода является его участие как окислителя в окислительно-восстановительных реакциях в организме. Благодаря наличию кислорода, организмы всех животных способны утилизировать (фактически «сжигать») различные вещества (углеводы, жиры, белки) с извлечением определенной энергии «сгорания» для собственных нужд. В покое организм взрослого человека потребляет 1,8-2,4 г кислорода в минуту.
Озо́н (от др.-греч. ὄζω— пахну) — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой газ. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, практически чёрные кристаллы.
Вопрос
Се́ра — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. sulfur). В водородных и кислородных соединениях находится в составе различныхионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы вводе.
На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом:

С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO[11].
Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором:

Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов (дихлорид серы и дитиодихлорид)[12]:


При избытке серы также образуются разнообразные дихлориды полисеры типа SnCl2.[13]
При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора[14], среди которых — высший сульфид P2S5:

Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием:
 (сероводород)
(сероводород)
 (сероуглерод)
(сероуглерод)
При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды:



 .
.
Растворы сульфидов щелочных металлов реагируют с серой с образованием полисульфидов:
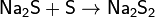
Из сложных веществ следует отметить прежде всего реакцию серы с расплавленной щёлочью, в которой сера диспропорционирует аналогично хлору:
 .
.
Полученный сплав называется серной печенью.
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании:
 (конц.)
(конц.) 
 (конц.)
(конц.) 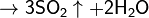
При увеличении температуры в парах серы происходят изменения в количественном молекулярном составе[15]. Число атомов в молекуле уменьшается:

При 800—1400 °C пары состоят в основном из двухатомной серы:

А при 1700 °C сера становится атомарной:

Биологическая роль: сера постоянно присутствует во всех живых организмах, являясь важным биогенным элементом. Ее содержание в растениях составляет 0,3-1,2 %, в животных 0,5-2 % (морские организмы содержат больше серы, чем наземные). Биологическое значение серы определяется прежде всего тем, что она входит в состав аминокислот метионина и цистеина и, следовательно, в состав пептидов и белков. Дисульфидные связи –S–S– в полипетидных цепях участвуют в формировании пространственной структуры белков, а сульфгидрильные группы (–SH) играют важную роль в активных центрах ферментов. Кроме того, сера входит в молекулы гормонов, важных веществ. Много серы содержится в кератине волос, костях, нервной ткани. Неорганические соединения серы необходимы для минерального питания растений. Они служат субстратами окислительных реакций, осуществляемых распространенными в природе серобактериями.
В организме среднего человека (масса тела 70 кг) содержится около 1402 г серы. Суточная потребность взрослого человека в сере — около 4.
Однако по своему отрицательному воздействию на окружающую среду и человека сера (точнее, ее соединения) стоит на одном из первых мест. Основной источник загрязнения серой — сжигание каменного угля и других видов топлива, содержащих серу. При этом около 96% серы, содержащейся в топливе, попадает в атмосферу в виде сернистого газа SO2.
В атмосфере сернистый газ постепенно окисляется до оксида серы (VI). Оба оксида — и оксид серы (IV), и оксид серы (VI) — взаимодействуют с парами воды с образованием кислотного раствора. Затем эти растворы выпадают в виде кислотных дождей. Оказавшись в почве, кислотные воды угнетают развитие почвенной фауны и растений. В результате создаются неблагоприятные условия для развития растительности, особенно в северных регионах, где к суровому климату добавляется химическое загрязнение. В результате гибнут леса, нарушается травяной покров, ухудшается состояние водоемов. Кислотные дожди разрушают изготовленные из мрамора и других материалов памятники, более того, они вызывают разрушение даже каменных зданий и изделий из металлов. Поэтому приходится принимать разнообразные меры по предотвращению попадания соединений серы из топлива в атмосферу. Для этого подвергают очистке от соединений серы нефть и нефтепродукты, очищают образующиеся при сжигании топлива газы.
Сама по себе сера в виде пыли раздражает слизистые оболочки, органы дыхания и может вызывать серьезные заболевания. ПДК серы в воздухе 0,07 мг/м3.
Многие соединения серы токсичны. Особенно следует отметить сероводород, вдыхание которого быстро вызывает притупление реакции на его неприятный запах и может привести к тяжелым отравлениям даже с летальным исходом. ПДК сероводорода в воздухе рабочих помещений 10 мг/м3, в атмосферном воздухе 0,008 мг/м3.
Оксид серы(II) (моноокси́д се́ры, моноокись серы) — бинарное неорганическое соединение. В нормальных условиях представляет собой бесцветный газ с резким, неприятным запахом. Реагирует с водой. В атмосфере Земли встречается крайне редко. Термодинамически неустойчив, существует в виде димера S2O2. Очень активно реагирует с кислородом, образуя диоксид серы.
Получение
Основной способ получения — сжигание серы:

Получается при разложении сернистого ангидрида:

Химические свойства
Растворяется в воде с образованием тиосерной кислоты:

Применение
Из-за редкости и неустойчивости у монооксида серы не нашлось применения.
Токсичность
Из-за нестабильности монооксида серы трудно определить его токсичность, но в концентрированном виде монооксид серы превращается в пероксид, который токсичен и едок.
Окси́д се́ры(IV) (диокси́д се́ры, двуокись серы, серни́стый газ, серни́стый ангидри́д) — соединение серы с кислородом состава SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой серни́стой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле и се́рной кислоте. Один из основных компонентов вулканических газов.
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:

В лабораторных условиях и в природе SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:


Также диоксид серы можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:

Химические свойства
Спектр поглощения SO2 в ультрафиолетовом диапазоне.
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):

Со щелочами образует сульфиты:

Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окислениясеры в таких реакциях повышается:





Предпоследняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):

Или для получения фосфорноватистой кислоты:
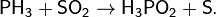
Применение
Большая часть оксида серы(IV) используется для производства сернистой кислоты. Используется также в виноделии в качестве консерванта (пищевая добавка E220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы(IV) используется для отбеливания соломы, шелка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. При таковом его применении следует помнить о возможном содержании в SO2 примесей в виде SO3, H2O, и, как следствие присутствия воды, H2SO4 и H2SO3. Их удаляют пропусканием через растворитель концентрированной H2SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре[1]. Оксид серы(IV) применяется также для получения различных солей сернистой кислоты.
Токсическое действие
SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
· ПДК(предельно допустимая концентрация):
· в атмосферном воздухе максимально-разовая — 0,5 мг/м³, среднесуточная — 0,05 мг/м³;
· в помещении (рабочая зона) — 10 мг/м³
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
Окси́д се́ры (VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Получение
Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt, NaVO3 илиоксид железа(III) Fe2O3):
Можно получить термическим разложением сульфатов:

или взаимодействием SO2 с озоном:

Для окисления SO2 используют также NO2:

Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:
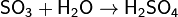
Однако в данной реакции серная кислота образуется в виде аэрозоля, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованиемолеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями:

и оксидами:

SO3 растворяется в 100%-й серной кислоте, образуя олеум.
' 2'. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:



3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:

Также взаимодействует с двухлористой серой и хлором, образуя тионилхлорид:

Применение
Серный ангидрид используют в основном в производстве серной кислоты.
Также серный ангидрид выделяется в воздух при сжигании серных шашек, применяющихся при обеззараживании помещений. При контакте с влажными поверхностями серный ангидрид превращается в серную кислоту, которая уже уничтожает грибок и прочие вредоносные организмы.
СЕРНИСТАЯ КИСЛОТА
H2S03H2S03, (S+4S+4) — сернистая кислота — кислота средней силы, отвечает степени окисления серы +4, непрочное соединение, существует только в водных растворах (в свободном состоянии не выделена), окисляется кислородом воздуха, превращаясь в серную кислоту H2S04H2S04, хороший восстановитель. Как двухосновная кислота, образует два ряда солей: гидросульфиты (NaHSO3NaHSO3, в избытке щелочи):
H2SO3+NaOH=NaHSO3+H2OH2SO3+NaOH=NaHSO3+H2O
и сульфиты (Na2SO3Na2SO3 - при недостатке щёлочи):
H2SO3+2NaOH=Na2SO3+2H2OH2SO3+2NaOH=Na2SO3+2H2O
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:
H2SO3+Br2+2O=H2SO4+2HBrH2SO3+Br2+2O=H2SO4+2HBr
При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
H2SO3+2H2S=3S+3H2OH2SO3+2H2S=3S+3H2O
Качественная реакция на сульфит-ионы — выделение газа с резким запахом (SO2SO2)при взаимодействии с кислотами:
SO2−3+2H+=SO2↑+H2OSO32−+2H+=SO2↑+H2O
Кроме того, раствор сульфит-ионов обесцвечивает раствор перманганат калия:
5SO2−3+6H++2MnO−4=5SO2−4+2Mn2++3H2O5SO32−+6H++2MnO4−=5SO42−+2Mn2++3H2O
Однако эта реакция реже применяется для качественного обнаружения сульфит-ионов.
Сернистую кислоту и её соли применяют как восстановители, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей (хлора). Сернистую кислоту применяют при консервировании плодов и овощей. Гидросульфит кальция (сульфитный щелок, Са(HSO3)2Са(HSO3)2) используют для переработки древесины в так называемую сульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнин — вещество, связывающее волокна целлюлозы, в результате чего волокна отделяются друг от друга; обработанную таким образом древесину используют для получения бумаги).
СЕРНАЯ КИСЛОТА
H2S04H2S04 (S+6S+6) — серная кислота — бесцветная маслянистая жидкость без запаха, нелетучая, кристаллизующаяся при 10,3010,30С, тяжелая, активно поглощает пары воды, сильный окислитель, двухосновная кислота, образует два ряда солей: сульфаты и гидросульфаты, из которых практически нерастворимы только BaS04BaS04, PbS04PbS04 и SrS04SrS04.
Подробно специфические свойства серной кислоты рассмотрены в теме "Взаимодействие серной кислоты с металлами и неметаллами".
За счет способности к замещению атомов водорода и серы и образования кислородных "мостиков", сера способна образовывать целый ряд кислородсодержащих кислот:
H2S207H2S207 (S+6S+6)— пиросерная, или двусерная кислота.
При растворении серного ангидрида S03S03 в серной кислоте получают олеум, состоящий главным образом из пиросерной кислоты. При охлаждении олеума кислота выделяется в виде бесцветных кристаллов. Пиросерная кислота образует соли — дисульфаты или пиросульфаты (Na2S2O7Na2S2O7), которые при нагревании выше температуры плавления разлагаются, превращаясь в сульфаты.
H2S02H2S02, ($S^{+2}) — (структурная формула H-O-S-O-H) сульфоксиловая кислота; в свободном состоянии не выделена.
H2S208H2S208, (S+6S+6) — пероксодвусерная, или надсерная, кислота, обладает сильными окислительными свойствами, образует соли персульфаты (структуру см. на рисунке 1).
H2S202H2S202 (S+4S+4) — тиосернистая кислота, образуется как промежуточный продукт при различных реакциях. Тиосернистая кислота может рассматриваться как сернистая кислота, в которой атом кислорода замещен на серу. В свободном состоянии не выделены ни сама кислота, ни ее соли.
H2S203H2S203 (S+4S+4 — тиосерная кислота — неустойчива, уже при комнатной температуре распадается, образует соли — тиосульфаты, которые значительно устойчивее кислоты и часто используются в промышленности как восстановители
H2S204H2S204 (S+4S+4— дитионистая или серноватистая кислота, существует только в виде солей.
Существует группа политионовых кислот, отвечающих общей формуле H2Sx06H2Sx06 (S+4S+4, где х принимает значения от 2 до 6. Политионовые кислоты неустойчивы и известны лишь в водных растворах. Соли их — политионаты — более устойчивы, некоторые из них получены в виде кристаллов.
Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да, дигидросульфи́д) — бесцветный газ со сладковатым вкусом, имеющий запах протухших куриных яиц. Бинарное химическое соединение водорода и серы. Химическая формула — H2S. Плохо растворим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях взаимодействует со многими металлами. Огнеопасен. Концентрационные пределы воспламенения в смеси с воздухом составляют 4,5—45 % сероводорода. Используется в химической промышленности для синтеза некоторых соединений, получения элементарной серы, серной кислоты, сульфидов. Сероводород также используют в лечебных целях, например, в сероводородных ваннах[1].
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
 K a = 6,9·10−7 моль/л; p K a = 6,89.л
K a = 6,9·10−7 моль/л; p K a = 6,89.л
Реагирует со щелочами:
 (средняя соль, при избытке NaOH)
(средняя соль, при избытке NaOH)
 (кислая соль, при отношении 1:1)
(кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. Окислительно-восстановительные потенциалы:

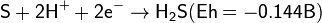
В воздухе горит синим пламенем:

при недостатке кислорода:
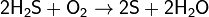 (на этой реакции основан промышленный способ получения серы).
(на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или ион SO42−, например:
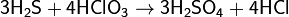

Качественной реакцией на сероводород, сероводородную кислоту и её соли является их взаимодействие с солями свинца, при котором образуется чёрный осадоксульфида свинца, например:

При пропускании сероводорода через человеческую кровь она чернеет, поскольку гемоглобин разрушается, и железо, входящее в его состав и придающее крови красный цвет, вступает в реакцию с сероводородом и образует чёрный сульфид железа.
Вопрос
Галоге́ны (от греч. ἁλός — «соль» и γένος — «рождение, происхождение»; иногда употребляется устаревшее название гало́иды) — химические элементы 17-й группы периодической таблицы химических элементов Д. И. Менделеева (по устаревшей классификации — элементы главной подгруппы VII группы)[1].
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается.
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к астату. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Al + 3F2 = 2AlF3 + 2989 кДж,
2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р); все реакции при этом сильно экзотермические, например:
Н2 + F2 = 2HF + 547 кДж,
Si + 2F2 = SiF4(г) + 1615 кДж.
При нагревании фтор окисляет все другие галогены по схеме
Hal2 + F2 = 2НalF
где Hal = Cl, Br, I, At, причем в соединениях HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с тяжёлыми инертными (благородными) газами:
Хе + F2 = XeF2 + 152 кДж.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
3F2 + ЗН2О = OF2↑ + 4HF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведём уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж,
2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж,
Si + 2Cl2 = SiCl4(Ж) + 662 кДж,
Н2 + Cl2 = 2HCl(г) + 185 кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + h ν → 2Cl,
Cl + Н2 → HCl + Н,
Н + Cl2 → HCl + Cl,
Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов (h ν), которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
СН3-СН3 + Cl2 → СН3-СН2Cl + HCl,
СН2=СН2 + Cl2 → СН2Cl — СН2Cl.
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
Cl2 + 2HBr = 2HCl + Br2,
Cl2 + 2HI = 2HCl + I2,
Cl2 + 2KBr = 2KCl + Br2,
а также обратимо реагирует с водой:
Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1 (в HCl), у других +1 (в хлорноватистой кислоте HOCl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде),
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
Si + 2Br2 = SiBr4(ж) + 433 кДж,
Н2 + Br2 = 2HBr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду».
Растворимость в воде иода — 0,3395 грамма на литр при 25 градусах Цельсия[4], это меньше, чем у брома. Водный раствор иода называется «иодной водой»[5]. Иод способен растворяться в растворах иодидов с образованием комплексных анионов:
I2 + I− → I−3.
Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов.[6]
Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием):
2Li + At2 = 2LiAt — астатид лития.
При диссоциации образуются не только анионы, но и катионы At+: HAt диссоциирует на:
2HAt=H++At-+H-+At+.
Водородные соединения галогенов (галогеноводороды) - бесцветные газы с резким запахом, дымящие во влажном воздухе. Они хорошо растворяются в воде, водные растворы их являются кислотами, носящими общее название - галогеноводородные кислоты. Соли галогеноводородных кислот (фториды, хлориды, бромиды и йодиды) могут быть получены при непосредственном соединении металлов с галогенами. По составу они однотипны и имеют сходные свойства. Так NaF, NaCl, NaBr, NaJ - белые кристаллические вещества, хорошо растворимые в воде. Наряду со сходством у галогенов наблюдаются и определенные различия как в физических, так и в химических свойствах. Однако изменение этих свойств происходит закономерно с возрастанием атомного веса галогена.
Водородные соединения галогенов - галогеноводороды HF, НС1, НВг и HI представляют собой бесцветные газы, хорошо растворяющиеся в воде. Из них HF - слабая кислота, а остальные галогеноводороды - сильные кислоты в водном растворе.
Поэтому водородные соединения галогенов более устойчивы, чем кислородные.
Поэтому водородные соединения галогенов более устойчивы, чем кислородные. Окислительно-восстановительные свойства и различия в химическом поведении галогенов легко понять, сравнивая эти свойства в зависимости от изменения заряда ядра при переходе от фтора к иоду. В ряду F, С1, Вг, I наибольшим радиусом атома (и, следовательно, наименьшим сродством к электрону) обладает иод, поэтому он характеризуется менее выраженными окислительными свойствами, чем бром, хлор и фтор.
Для водородных соединений галогенов разрешено использовать следующие названия: фтороводород, хлороводород, бро-моводород и иодоводород. Названия типа хлороводородная кислота относятся к водным растворам галогеноводородов.
Образование водородных соединений галогенов идет с большим выделением тепла, чем кислородных, поэтому водородные соединения устойчивее кислородных. Из кислородных соединений наиболее устойчивы соли кислородных кислот и наименее устойчивы оксиды.
| Кислородсодержащие соединения галогенов Все кислородные соединения галогенов получены косвенным путем. Наиболее устойчивы соли, наименее — оксиды и кислоты. Для галогенов характерно образование большого числа оксидов, отвечающих различным степеням окисления. Больше всего ионы BrO-2 и IO-2 очень неустойчивы. устойчивых оксидов образует хлор Сl, меньше всего — иод I. Из соединений кислорода с фтором существует фторид кислорода F-12О+2: Связь между атомами фтора и кислорода ковалентная, очень близка к неполярной. Это бесцветный газ с резким запахом озона, плохо растворим в воде, tкипения=-145°С. Был открыт в 1929 году. получается взаимодействием фтора с 2% -ным раствором гидроксида натрия: 2F2+2NaOH=2NaF+Н2О+F2O I Рассмотрим важнейшие из кислородных соединений остальных галогенов. Все оксиды неустойчивы, разлагаются с большим выделением тепла. Оксид хлора (I) Сl2О — газ буро-желтого цвета с неприятным запахом. Характеризуется низкой температурой кипения, относительная плотность по воздуху равна 3. Связь в молекуле оксида малополярная ковалентная. Обладает следующими химическими свойствами: 1. При нагревании легко распадается (со взрывом) на хлор и кислород: 2С12O=t2Сl2+О2 2. Будучи кислотным оксидом, гидратируется с образованием хлорноватистой кислоты: Сl2O+Н2O=2НСlO 3. Взаимодействует с щелочами и основными оксидами: Сl2O+2NaOH=2NaClO+Н2O Сl2O+K2O=2KСlO Оксиду хлора (I) соответствует хлорноватистая кислота. Хлорноватистая кислота НСlO и ее бромный и йодный аналоги — очень слабые кислоты, причем их сила уменьшается при переходе от НСlO к НIO. Это объясняется тем, что хлор обладает большей электроотрицательностью и сильнее своих аналогов притягивает электронную пару, связывающую его с кислородом. Это в свою очередь приводит к смещению электронной пары, связывающей водород с кислородом, к кислороду и увеличению способности водорода к отщеплению. Хлорноватистая кислота представляет собой раствор желто-зеленого цвета с характерным запахом. Она и ее аналоги обладают всеми свойствами слабых летучих кислот, являются кислотами-окислителями. Причем окислительная активность в ряду НСlO, НBrO, НIO снижается. 1. На свету хлорноватистая кислота разлагается: НСl+1O-2 =hv НСl-1+О0 2. При действии водоотнимающих средств распадается: 2НСl+1O=Сl+12O+Н2О 3. При нагревании хлорноватистой кислоты образуется соляная и хлорноватая кислоты: 3НСl+1О=2НСl-1+НСl+5O3 окислитель Сl++2е- Сl-восстановитель Сl+-4е- Сl+5 Наибольшее значение имеют соли кислородных кислот хлора. Все их можно получить, исходя из реакции взаимодействия хлора с водой. НСl+НСlO«Сl2+Н2О Равновесие этой реакции легко сместить в сторону продуктов реакции, добавив в раствор щелочи, которая реагирует с двумя образующимися кислотами: НСl+НСlO+2КОН=КСl+КСlO+2Н2O I Просуммировав эти два уравнения, получим: Сl2+2КОН=КСl+КСlO+Н2O Сl2+2OH-=Сl-+СlO-+Н2О Соли хлорноватистой кислоты называют гипохлоритами. Водный раствор, содержащий гипохлорит и хлорид калия, называют жавелевой водой. Она, как и хлорная (раствор хлора в воде) вода, употребляется для беления хлопчатобумажной ткани и бумаги. Механизм окисляющего и дезинфицирующего действия хлорноватистой кислоты и ее солей объясняют наличием хлора со степенью окисления +1, проявляющего в этих процессах активные окислительные свойства. Сl++1e-Сl° Сl++2e-Сl- Гипохлориты — очень сильные окислители. При пропускании хлора в раствор щелочи, нагретый до 100°С, процесс протекает с образованием хлоратов (солей хлорноватой кислоты НСlO3) и хлоридов: ЗСl2+6КОН=5КСl+КСlO3+3Н2O ЗСl2+6OH-=5Сl-+СlO-3+3Н2О При нагревании до 400°С в отсутствие катализаторов из хлоратов образуются перхлораты (соли хлорной кислоты НСlO4): 4КСlO3=3КСlO4+КСl В присутствии катализатора (MnO2) процесс протекает по уравнению: 2КСlO3=2КСl+3O2 Таким образом, соли кислородных кислот хлора получают взаимодействием хлора с щелочью. При этом при комнатной температуре образуются гипохлориты, при 100°С — хлораты. Это окисли-тельно-восстановительные реакции. Хлористая кислота НСlО2 — средней силы. Она малоустойчива в водных растворах, а ее аналоги брома и иода еще менее прочны. Сила кислородных кислот хлора возрастает с ростом степени окисления центрального атома: НСl+1O — слабая; НСl+3O2 — несколько более сильная; НСl+5O3 — очень сильная и НСlO+74 — самая сильная из всех известных кислот. Если хлор взаимодействует с гидроксидом кальция, который берется в виде порошка — пушонки, то образуется хлорная, или белильная, известь — рыхлый белый порошок с запахом хлора. Она состоит главным образом из гипохлорита кальция Са(СlO)2, основных солей кальция и хлорида кальция. Примерное уравнение: 2Сl2+2Са(ОН)2=Са(СlO)2+СаСl2+2Н2О Часто для повышения качества хлорной извести к ней добавляют Са(СlO)2. Хлорная известь — сильный окислитель. Она очень реакционноспособна. Применяется для беления хлопчатобумажных тканей, бумаги, для хлорирования воды, дезинфекции, а также для дегазации местности, зараженной стойкими отравляющими веществами. Белящие и дезинфицирующие свойства хлорной извести аналогичны свойствам жавелевой и хлорной воды: угольная кислота вытесняет из гипохлорита кальция хлорноватистую кислоту; на свету она разлагается с выделением атомарного кислорода, который и оказывает окисляющее действие. |
Вопрос
Функции йода в организме
Йод необходим для образования гормонов щитовидной железы и для функционирования макрофагов. Макрофаги – это особые клетки, которые уничтожают различные патогенные микробы, вирусы, грибки и т.д.
Какие заболевания вызывает недостаток йода. Причины йододефицита
Недостаток йода в организме человека вызывает серьезные заболевания обмена веществ (заболевания щитовидной железы), отклонения в умственном развитии, а также может приводить к повреждениям хромосом и развитию рака. В крови увеличивается концентрация холестерина, нарушаются все виды обмена веществ. Возможно развитие глухоты, немоты, параличей, стерильности, врожденных пороков развития, невынашивания беременности, сонливости, отеков, урежение частоты сердечных сокращений.
Недостаток йода развивается вследствие недостаточного поступления с пищей и водой, воздействия радиации или вследствие приема некоторых препаратов.
Норма потребления фтора. Роль в организме человека
Фтор – неоднозначный элемент. Для здоровья человека опасны и избыток, и недостаток фтора. Фтор содержится в костях и зубах, является необходимым элементом для строительства костной ткани. Для человека достаточное количество фтора составляет 1-1,5 мг на 1 литр воды. Мы приводим данные на литр воды, поскольку соединения фтора легко растворимы. Фтор содержится практически во всех продуктах питания и различных напитках. На сегодняшний день невозможно говорить о развитии дефицита фтора, поскольку практически все почвы содержат избыток фтора, который в избытке накапливается в сельскохозяйственных культурах.
Что вызывает избыток и недостаток фтора?
Самый известный эффект недостатка фтора в организме – это развитие кариеса зубов. Избыток же фтора вызываетостеохондроз, изменения формы и цвета зубов (флюороз зубов), тугоподвижность суставов и образование костных наростов. Отмечены потеря голоса, сухой удушливый кашель, снижение давления, кровоизлияния. Контакт с фтором вызывает заболевания кожи (зуд, раздражение, слущивание) и слизистых оболочек, а также резко увеличивает риск развития рака желудочно-кишечного тракта.
Причины избытка фтора в современных продуктах. Какие продукты содержат очень много фтора
Любители такого широко распространенного напитка как чай должны знать, что чем крепче чай, и чем дольше вы его настаиваете, тем больше напиток содержит фтора. В 1 литре красного вина содержится 5 мг фтора – максимальная суточная доза. Избыток фтора содержит криль. Вообще чрезмерное применение неорганических удобрений в сельскохозяйственном производстве привело к накоплению соединений фтора практически во всех растениях.
Вопрос
Желе́зо — элемент восьмой группы (по старой классификации — побочной подгруппы восьмой группы) четвёртого периода периодической системы химических элементовД. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо — ковкий металл серебристо-белого цветас высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
 2018-01-21
2018-01-21 1821
1821
