o фосфор входит в состав многих веществ организма (фосфолипиды, фосфопротеиды, нуклеотиды, коферменты, ферменты и пр.)
o фосфолипиды являются основным компонентом мембран всех клеток в организме человека
o в костях фосфор находится в виде гидроксилапатита, в зубах в виде фторапатит, выполняя структурную функцию
o остатки фосфорной кислоты входят в состав нуклеиновых кислот и нуклеотидов, а также в состав аденозинтрифосфорной кислоты (АТФ) и креатинфосфата – важнейшие аккумуляторы и переносчики энергии
o остатки фосфорной кислоты входят в состав буферной системы крови, регулируя ее значение рН
o Фосфорные удобрения - одни из основных удобрений, повышающие урожайность и качество продукции. Содержат фосфор, положительно влияющий на генеративные органы растения (см. подробнее). Поэтому внесение фосфорных удобрений особенно важно для культур, товарными органами которых являются семена и плоды (зерновые, плодовые, ягодные, большинство овощей).
o Общие признаки фосфорного голодания: овощные растения приостанавливают рост, листья и молодые стебли приобретают цвет от темно-зеленого до сине-зеленого; у плодовых - стебли и отдельные листья становятся сизо-розовыми или приобретают коричнево-зеленую окраску.
o Фосфорные удобрения не так опасны для растений даже при очень высоких нормах внесения (в отличие от азотных), так как не повышают концентрации почвенного раствора. Однако и для них нужно придерживаться определенных норм внесения, зависящих от плодородия почвы и видов применяемых удобрений.
o Норму внесения можно рассчитать самостоятельно для определенного фосфорного удобрения под каждую культуру (см. расчет нормы внесения). Это желательный и наиболее точный способ определить норму внесения, но для этого желательно знать запасы фосфора в Вашей почве (образцы анализируются в специальных лабораториях, которые есть в любых крупных городах).
o Менее точный, но более простой способ - воспользоваться рекомендуемыми нормами внесения азота (см. раздел "Удобрения" в "Технологиях выращивания" конкретных культур) и вычислить норму для определенного удобрения, зная процентное содержание в нем фосфора (указано на упаковке или см. ниже). Например, если под лук рекомендуется вносить 15 г фосфора на 1 м2, то двойного суперфосфата (содержание фосфора 45%) нужно будет 15 * 100 / 45 = 33 г/м2. К сожалению, при этом не учитывается содержание фосфора в почве.
o Самый легкий, но неточный способ - просто следовать общим рекомендациям на упаковке удобрения. Как правило, в этом случае также можно получить хорошие результаты.
o Существуют различные способы внесения удобрений, но в любом случае удобрения должны быть быстро заделаны в почву. В открытом грунте основная часть удобрений вносится осенью под перекопку (вспашку), так как фосфор некоторых удобрений, в отличии от азота, плохо или практически не проходит в корнеобитаемые глубокие слои почвы "самостоятельно" (с дождевой или поливной водой). Оставшаяся часть фосфорных удобрений (как правило, 20-30% от общей нормы) вносится весной перед посевом или при посеве, а также в подкормках.
o Наиболее распространены следующие фосфорные удобрения.
o Двойной суперфосфат - Ca(H2PO4)2*H2O
o Наиболее концентрированное удобрение (содержание фосфора 45-50%). В объеме 10 см3 содержится 10 г (1 г занимает 1 см3), т.е. в стакане (200 мл) поместится 200 г, в спичечном коробке 20 г. Удобрение растворимо в воде, хорошо смешивается с другими удобрениями, вносится под все растения на любых почвах.
o По сравнению с другими удобрениями, не содержит балластных веществ и не вызывает засоление почвы. Поэтому является лучшим фосфорным удобрением для защищенного грунта, где вносится двумя способами: вразброс или локально. Вразброс - всю норму (15-20 г/м2) распределяют по поверхности с последующей заделкой. Локально - вносят в борозды (15 г/м2), в лунки (1-2 г на одно растение перед высадкой рассады) и в горшочки при выращивании рассады (1,5 кг двойного суперфосфата и 0,4 кг калийной селитры на 100 л почвы). В октрытом грунте вносят согласно рекомендациям.
o Суперфосфат простой гранулированный - Ca(H2PO4)2*H2O + 2CaSO4 и примеси
o Содержание фосфора 14-20%. В объеме 10 см3 содержится 11 г (1 г занимает 0,9 см3), т.е. в стакане (200 мл) поместится 220 г, в спичечном коробке 22 г. Удобрение растворимо в воде, смешивается с аммиачной селитрой, вносится под все растения и на некислых почвах.
o Суперфосфат простой порошковый - Ca(H2PO4)2*H2O + 2CaSO4 и примеси
o Содержание фосфора 14-20%. В объеме 10 см3 содержится 12 г (1 г занимает 0,85 см3), т.е. в стакане (200 мл) поместится 240 г, в спичечном коробке 24 г. Удобрение растворимо в воде. Нельзя смешивать с аммиачной и кальциевой селитрой. Вносится под все растения. Наибольший эффект дает на нейтральных и щелочных почвах.
o Фосфоритная мука - Ca3(PO4)2*CaCO3 с примесью 3Ca3(PO4)2*CaF2 и соединений железа, алюминия и др.
o Содержание фосфора 19-30%. В объеме 10 см3 содержится 17 г (1 г занимает 0,6 см3), т.е. в стакане (200 мл) поместится 340 г, в спичечном коробке 34 г. Удобрение труднорастворимо в воде. Смешивается с любыми удобрениями. Преимущественно вносится под полевые культуры, реже под овощные. Наибольший эффект дает на кислых почвах.
o Фосфор содержится также в большинстве сложных удобрений: аммофос (39-50%, в зависимости от марки), диаммонийфосфат (49%), нитроаммофос (23-25%), нитроаммофоска (17-19%), нитрофос (14-17%), карбоаммофос (26%) и т.д.
Вопрос
Кислоро́д — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), второго периода периодической системы химических элементов Д. И. Менделеева, сатомным номером 8. Обозначается символом O (лат. Oxygenium). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород (CAS-номер: 7782-44-7) при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
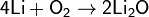
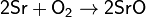
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
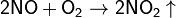
Окисляет большинство органических соединений:
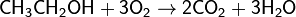
При определённых условиях можно провести мягкое окисление органического соединения:
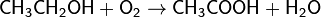
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au иинертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём полученыоксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
· Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
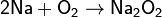
· Некоторые оксиды поглощают кислород:
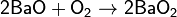
· По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
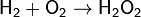
· В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
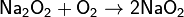
· Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
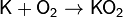
· Неорганические озониды содержат ион O−3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
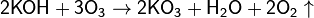
· В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
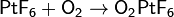
Фториды кислорода [править | править вики-текст]
· Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через раствор щелочи:
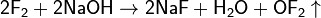
· Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
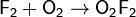
· Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
· Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония (англ.)[20] OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3[21][22].
 2018-01-21
2018-01-21 1193
1193
