При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующей дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
Взаимодействует с кислотами
· С соляной кислотой:
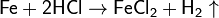
· С разбавленной серной кислотой:
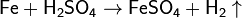
· Концентрированные азотная и серная кислоты пассивируют железо. C концентрированной серной кислотой взаимодействует только при нагревании:
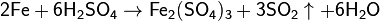
· Взаимодействие с кислородом:
· Железо горит в кислороде, нагретое горит на воздухе, пирофорное — на воздухе без нагревания:

· Пропускание кислорода или воздуха через расплавленное железо:
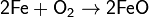
· Взаимодействие с порошком серы при нагревании:

· Взаимодействие с галогенами при нагревании:
· Горение в хлоре:
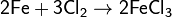
· При повышенном давлении паров брома:
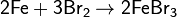
· Взаимодействие с йодом:
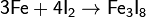
· Взаимодействие с неметаллами:
· С азотом при нагревании:
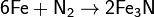
· С фосфором при нагревании:
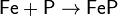


· С углеродом:
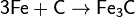
· С кремнием:
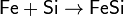
· Взаимодействие раскалённого железа с водяным паром:
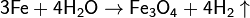
· Железо восстанавливает металлы, которые в ряду активности стоят правее него, из растворов солей:

· Железо восстанавливает соединения железа(III):
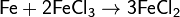
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) CO, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом.
Соединения железа (II) [править
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):

Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3−выпадает осадок гексацианоферрата (III) калия-железа (II) (берлинская лазурь):

который внутримолекулярно перегруппировывается в гексацианоферрат (II) калия-железа (III):
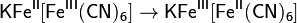
Для количественного определения железа (II) в растворе используют фенантролин Phen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9).
 2018-01-21
2018-01-21 328
328








