В центре атома – положительно заряженное ядро. Вокруг ядра вращаются e. Число e опр. полож. зарядом атома.
Волновое уравнение де Бройля
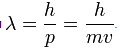
Принцип неопределённость Гейзенберга: невозможно одновременно точно определить и положение электрона в пространстве и его скорость(импульс), минимальная возможная неточность равна h.
Квантовые числа и их физический смысл. Квантово-механические законы: принцип минимальной энергии, принцип Паули, правило Хунда, правило Клечковского.
Квантовые числа и их физический смысл. Главное квантовое число n опр. полную энергию
1) Орбитально-квантовое число (e облака отл. не только размером но и формой)
2)Магнитное- квантовое число (опр. пространств. напр. e облаков
3)Спиновое число (хар. напр. вращения e вокруг своей оси)
Принцип минимальной энергии: В невозб. атоме e распол. таким уровнем, чтобы обесп. прочная связь с ядром и энергия атома была min.
Принцип Паули: В атоме не может быть двух e с одинаковым набором всех 4ех квантовых чисел. Каждая орбиталь не может сод. Более 2х е.
Правило Хунда: Объясняет порядок заполнения e квантового подуровня, таким обр. чтобы сумарный спин был максимален.
Правило Клечковского: При увел. Заряда ядра атома, посл. заполнение орбиталей происх в порядке возрастания суммы (n+1).
Периодический закон Менделеева и электронная конфигурация атомов.
Периодический закон Менделеева: Свойство элементов и их соединений наход. В периодической зависимости от заряда ядра атома или порядкового номера элемента.
Электронная конфигурация атомов: В первую очередь заполн. наиболе низкие по энергии уровни и подуровни в соотв с их емкостью
1H 1s1
Стр.вверх
1+
1e
 2018-01-21
2018-01-21 757
757







