Самая напряженная система – это циклопропан. Он легко гидрируется с разрывом С – С-связи, что имеет сходство с алкенами, то есть легко присоединяет атомы водорода:

 CH2 – CH2 + H2 Pt, 250C CH3 – CH2 – CH3
CH2 – CH2 + H2 Pt, 250C CH3 – CH2 – CH3
 CH2 Ni, 00C
CH2 Ni, 00C
циклопропан пропан
У алкилзамещенных циклопропана реакция идет двумя путями:
1) происходит разрыв С – С-связи между наиболее насыщенными углеродными атомами;
2) сначала алкилзамещенные циклопропана изомеризуются в алкены с разрывом связей у менее насыщенного углеродного атома, потом идет процесс гидрирования.
Эти пути зависят от катализатора:
1) Pt / C



 2 CH2 CH3 – CH – CH3
2 CH2 CH3 – CH – CH3


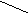 CH3 – CH 1) + H2 CH3
CH3 – CH 1) + H2 CH3
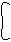 2) CH2 изобутан
2) CH2 изобутан
 метилциклопропан 2)(алюмосиликаты, СН3–СН=СН–СН3 [H2] CH3(CH2)2CH3
метилциклопропан 2)(алюмосиликаты, СН3–СН=СН–СН3 [H2] CH3(CH2)2CH3
 силикагель, как СН2=СН–СН2–СН3
силикагель, как СН2=СН–СН2–СН3
активные носители) изомеры бутен-2 и бутен-1 бутан
Гидрогенолиз алкилбутанов не так специфичен, как алкилциклопропанов. С – С-связи разрываются примерно одинаково:



 СН2 СН – R
СН2 СН – R
 50%
50%
 CH2 CH2
CH2 CH2
50%
алкилциклобутан
У циклопентанов гидрогенолиз идет с большим трудом. Казанский Б.А., изучая эту реакцию, установил, что алкилциклопентаны дают следующие продукты:
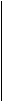
 1) СН3 – СН2 – СН2 – СН2 – СН2 – СН3
1) СН3 – СН2 – СН2 – СН2 – СН2 – СН3
 СН3 гексан (12%)
СН3 гексан (12%)
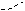
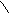
 СН 1) Н2
СН 1) Н2




 СН2 СН2 2) СН3 – СН – СН2 – СН2 – СН3
СН2 СН2 2) СН3 – СН – СН2 – СН2 – СН3
 2) СН3
2) СН3
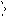
 СН2 СН2 3) 2 – метилпентан (66%)
СН2 СН2 3) 2 – метилпентан (66%)

 3) СН3 – СН2 – СН – СН2 – СН3
3) СН3 – СН2 – СН – СН2 – СН3
метилциклопропан СН3
3 – метилпентан (22%)
Трудность разрыва С – С-связи возрастает в порядке 2 > 3 > 1.
Циклогексан уже не гидрируется.
Гидрогалогенирование
Гидрогалогенирование довольно легко происходит у циклопропана и его алкилзамещенных. Реакция присоединения идет по ионному механизму в соответствии с правилом Марковникова, что имеет сходство с алкенами:
 |
AE



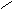
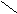
 СН3 – СН СН2 + Hδ+Brδ– CH3 – CH – CH2 – CH3
СН3 – СН СН2 + Hδ+Brδ– CH3 – CH – CH2 – CH3
CH2 Br
метилцмклопропан 2 – метилбутан
Циклобутан присоединяет галогеноводороды с трудом и при нагревании:



 СН2 – СН2 + НBr CH2 – CH2 – CH2 – CH3
СН2 – СН2 + НBr CH2 – CH2 – CH2 – CH3
CH2 – CH2 Br
циклобутан 1 – бромбутан
Остальные циклоалканы галогеноводороды практически не присоединяют.
Окисление
Окисление циклоалканов дает разные продукты реакции в зависимости от условий ее проведения.
В жестких условиях при действии сильных окислителей циклы разрываются с образованием двухосновных кислот с тем же числом атомов углерода, что и исходное соединение. Этим отличаются циклоалканы от алкенов, которые окисляются в подобных условиях с разрывом углеродной цепи по месту нахождения двойной связи и образуют кислоты с меньшим числом углеродных атомов. Например,
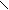
 СН2
СН2

 CH2 CH2 [O] HOOC – CH2 – CH2 – CH2 – CH2 – COOH
CH2 CH2 [O] HOOC – CH2 – CH2 – CH2 – CH2 – COOH


 CH2 CH2 CrO3 адипиновая кислота
CH2 CH2 CrO3 адипиновая кислота
CH2
циклогексан
[O]
 СН3 – СН = СН – СН2 – СН2 – СН3 CrO3 СН3 – СООН + СН3 – СН2 – СН2 – СООН
СН3 – СН = СН – СН2 – СН2 – СН3 CrO3 СН3 – СООН + СН3 – СН2 – СН2 – СООН
гексен – 2 уксусная кислота масляная кислота
В мягких условиях окисление сопровождается сужением или расширением циклов (реакция Кижнера, Демьянова).
При сужении кольца атомы углерода кольца переходят в боковую цепь. Расширение цикла – наоборот, внедрение в кольцо атомов углерода из боковой цепи.
В качестве мягкого окислителя применяют азотистую кислоту:


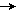


 CH2 – CH – NH2 HNO2 CH2 – CH – OH
CH2 – CH – NH2 HNO2 CH2 – CH – OH
 CH2 – CH2 – N2 ↑ CH2 – CH2
CH2 – CH2 – N2 ↑ CH2 – CH2
циклобутиламин циклобутанол
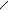
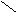 (аминоциклобутан) CH2 – CH2
(аминоциклобутан) CH2 – CH2
CH – CH2 – OH
оксиметилциклопропан

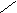
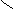
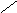 CH2 CH2
CH2 CH2



 CH2 CH2 AlCl3 CH2 CH – CH3
CH2 CH2 AlCl3 CH2 CH – CH3

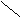

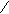
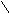 CH2 CH2 2500 CH2 CH2
CH2 CH2 2500 CH2 CH2
CH2 – CH2 CH2
циклогептан метилциклогексан





 CH2 – CH2 AlCl3 CH2 – CH2 AlCl3 CH2
CH2 – CH2 AlCl3 CH2 – CH2 AlCl3 CH2





 CH2 – CH – CH2 – CH3 холод CH2 CH2 холод CH2 CH2
CH2 – CH – CH2 – CH3 холод CH2 CH2 холод CH2 CH2
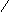
 CH – CH3 CH2 CH2
CH – CH3 CH2 CH2
CH2
этилциклобутан метилциклопентан циклогексан
 2018-01-21
2018-01-21 551
551








