Типичные восстановители
1. Металлы I, II, III групп периодической системы. (Na, Ca, Al …)
2. Катионы металлов в низшей степени окисления ( ).
).
3. Ионы неметаллов в низшей степени окисления ( ).
).
4. Технические восстановители ( ).
).
5. Гидриды металлов ( ).
).
Типичные окислители.
1. Галогены ( ).
).
2. Кислород  .
.
3. Катионы металлов высшей степени окисления ( ).
).
4.  и
и  .
.
Неметаллы промежуточной степени окисления обладают окислительно-восстановительной двойственностью:
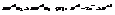

Азотная кислота

 – электрохимический ряд напряжений.
– электрохимический ряд напряжений.
 |
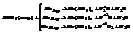

 Серная кислота
Серная кислота




№2
Реакции окисления-восстановления. Метод электронного баланса.
Окислительно-восстановительные реакции:
1. Реакции межмолекулярного окисления-восстановления
 ;
;
2. Реакции диспропорционирования:
 ;
;
3. Реакции внутримолекулярного окисления-восстановления:
 .
.
Существует 2 метода составления окислительно-восстановительных реакций:
1) метод электронного баланса,
2) метод полуреакций.
В методе электронного баланса сравниваются степени окисления атомов в исходных и конечных веществах, а в методе полуреакций – составляются ионные уравнения.
Метод электронного баланса.




Правила расстановки коэффициентов.
 .
.
1. Составить схему ОВР, включив в неё только те атомы, которые изменили степень окисления:

2. Записать реакцию в виде двух полуреакций, отвечающих процессам окисления и восстановления:

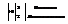

3. Поместить полученные коэффициенты в молекулярное уравнение:
4. Проверить, расходуется ли окислитель и восстановитель на другие процессы.
№3.
 2018-01-21
2018-01-21 730
730







