Таким образом, неравновесному состоянию макросистемы соответствует меньшая энтропия, чем равновесному. Но в неравновесном состоянии мы можем иметь больше информации о системе, чем в равновесном. Чем меньше энтропия, тем большую информацию мы можем иметь о системе. Поэтому отрицательную энтропию или негэнтропию рассматривают как меру возможной информации о системе. Следовательно, информацию можно определить как разность энтропии равновесного и рассматриваемого неравновесного состояний:
 .
.
Рассмотрим следующий пример. Пусть имеется N атомов, каждый из которых может находиться в одном из двух состояний. Пример микросостояния такой системы приведен в следующей таблице:
| | ¯ | ¯ | | | ¯ | ¯ | ... | … | ¯ | | ¯ | |
Если состояниям атомов поставить в соответствие цифры 1 или 0, то каждое микросостояние можно охарактеризовать одним из 2 N двоичных чисел:
| … | … |
Пусть система находится в равновесном состоянии. Так как каждый атом с равной вероятностью может находиться в любом из двух состояний, число микросостояний W 0 = 2 N. (Если энергии состояний отличаются незначительно, то количество атомов в состоянии 1 приблизительно равно числу атомов в состоянии 0). Энтропия состояния максимальна и равна по величине
 ,
,
а информация о системе равна нулю:
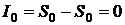 .
.
Пусть теперь состояние одного из атомов зафиксировано, т.е. мы знаем, в каком из двух состояний он находится. Тогда число микросостояний, отвечающих данному макроскопическому состоянию системы, уменьшается до W 1 = 2 N –1. Энтропия и информация соответственно равны:
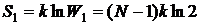 ,
,  .
.
Если зафиксировать состояние двух атомов, то энтропия и информация будут равны:
 ,
,  .
.
Продолжая этот процесс до конца, придем к такому состоянию системы, когда каждый атом однозначно будет находиться в определенном состоянии: WN = 1. В этом случае энтропия системы равна нулю, а информация о системе максимальна:
 ,
,  .
.
Отсюда видно, что в единицах СИ минимальный объем информации как физической величины, называемый битом, равен
 Дж/К.
Дж/К.
Итак, информация является мерой упорядоченности в системе, а энтропия является мерой беспорядка или хаоса.
Задача 6.1. При изотермическом расширении (T = 300 К) объем одного моля идеального газа увеличился в два раза, что соответствует увеличению хаотичности и уменьшению определенности в положениях частиц. Определите уменьшение информации о системе. Какое количество теплоты было сообщено газу?
Решение. Уменьшение информации о системе из-за увеличения ее хаотичности равно увеличению энтропии:
 .
.
Энтропия равна  , где W – число состояний системы. Поэтому ее изменение в процессе
, где W – число состояний системы. Поэтому ее изменение в процессе
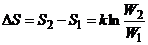 .
.
При увеличении объема газа вдвое, число состояний (положений) каждой частицы удваивается. Для NA частиц число состояний увеличивается в  раз:
раз:  . В результате получаем изменение информации
. В результате получаем изменение информации
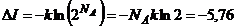 Дж/К= – 6,02×1023 бит.
Дж/К= – 6,02×1023 бит.
Количество теплоты, полученное газом в процессе, равно
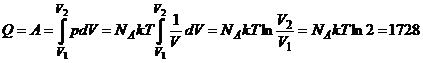 Дж.
Дж.
Легко видеть, что  . Сообщение теплоты сопровождается увеличением энтропии системы и уменьшением информации о ней.
. Сообщение теплоты сопровождается увеличением энтропии системы и уменьшением информации о ней.
Задача 6.2. Определите потерю информации: а) в процессе таяния одного грамма льда при t пл = 0° С; б) в процессе превращения в пар одного грамма воды при t кип = 100° С. Удельная теплота плавления льда l = 3,3×105 Дж/кг, удельная теплота парообразования воды r = 2,3×106 Дж/кг.
Решение. При плавлении льда увеличивается неопределенность в положениях молекул из-за разрыва связей, скорости же молекул практически не изменяются. Энтропия увеличивается на величину
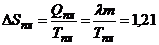 Дж/К.
Дж/К.
Изменение информации о системе равно
 = –1,21 Дж/К = –1,26×1023 бит.
= –1,21 Дж/К = –1,26×1023 бит.
Аналогично находим изменение энтропии и информации при испарении воды
 Дж/К = –6,45×1023 бит.
Дж/К = –6,45×1023 бит.
Отсюда видно, что изменение информации в процессах плавления и парообразования составляет величину порядка 1023 бит на грамм вещества. Это примерно на 11 порядков больше достигаемой сегодня плотности записи информации ~1012 бит на грамм вещества.
Задача 6.3. В изолированной от внешней среды системе, состоящей из двух металлических тел одинаковой теплоемкости C, разделенных перегородкой с малой теплопроводностью, устанавливается тепловое равновесие. Начальные температуры тел равны T 1 и T 2. Определите уменьшение информации о системе в процессе установления равновесия, т.е. в процессе ее хаотизации.
Решение. Равновесная температура T находится из условия теплового баланса:
 ,
, 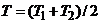 .
.
Изменение энтропии системы равно
 .
.
Подставим равновесную температуру:
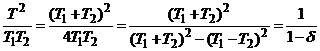 ,
,
где
 > 0.
> 0.
Изменение энтропии системы равно
 .
.
Так как d > 0, из последней формулы следует, что D S > 0. Энтропия системы в процессе установления равновесия возрастает, что соответствует закону возрастания энтропии. Информация о системе уменьшается:
 .
.
 2018-01-21
2018-01-21 1353
1353
