Мышья́к (As) — химический элемент15-й группы четвёртого периода периодической системы; имеет атомный номер 33. Простое вещество представляет собой хрупкий полуметалл стального цвета с зеленоватым оттенком.
Мышьяк — рассеянный элемент. Содержание в земной коре 1,7·10−4% по массе. В морской воде 0,003 мг/л. Этот элемент иногда встречается в природе в самородном виде. Известно около 200 мышьяковосодержащих минералов.
Минерал, имеющий промышленное значение для получения мышьяка, — арсенопирит FeAsS также перерабатывают мышьяковистый колчедан — лёллингит (FeAs2), скородит FeAsO4. Большая часть мышьяка добывается попутно при переработке мышьяковосодержащих золотых, свинцово-цинковых, медноколчеданных
Основной способ получения — обжиг сульфидных руд с последующим восстановлением оксида углем:

На воздухе при обычных условиях мышьяк слегка окисляется с поверхности. Ни в воде, ни в органических растворителях мышьяк и его аналоги нерастворимы. Мышьяк химически активен. На воздухе при нормальной температуре даже компактный (плавленый) металлический мышьяк легко окисляется, при нагревании порошкообразный мышьяк воспламеняется и горит голубым пламенем с образованием оксида As2O3. Известен также термически менее устойчивый нелетучий оксид As2O5.
Мышьяк относится к группе элементов окислителей-восстановителей. При действии сильных восстановителей он проявляет окислительные свойства.
При действии металлов и водорода в момент выделения он способен давать соответствующие металлические и водородистые соединения:
6Ca +As4 = 2Ca3As2.
Сурьма́ (Sb) химический элемент 15-й группы пятого периода периодической системы химических элементов Д. И. Менделеева; имеет атомный номер 51. Сурьма — полуметалл серебристо-белого цвета с синеватым оттенком, грубозернистого строения. Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма).
Из осадочных пород наиболее высокие концентрации сурьмы отмечаются в глинистых сланцах (1,2 г/т), бокситах и фосфоритах (2 г/т) и самые низкие в известняках и песчаниках (0,3 г/т). Повышенные количества сурьмы установлены в золе углей.
Способ получения — обжиг сульфидных руд с последующим восстановлением оксида углем:

В обычных условиях сурьма в воде не растворяется. Хорошо взаимодействует в виде сплава сурьмы с другими металлами, так как основное ее достоинство – это увеличение твердости металлов. Даже если добавить к свинцу 1% сурьмы его прочность уже значительно увеличится.
Ви́смут (Bi) — химический элемент 15-й группы шестого периода периодической системы химических элементов Д. И. Менделеева; имеет атомный номер 83. Представляет собой при нормальных условиях блестящий серебристый с розоватым оттенком металл.
Содержание висмута в земной коре — 2·10−5 % по массе, в морской воде — 2·10−5 мг/л.
В рудах находится как в форме собственных минералов, так и в виде примеси в некоторых сульфидах и сульфосолях других металлов. В мировой практике около 90 % всего добываемого висмута извлекается попутно при металлургической переработке свинцово-цинковых, медных, оловянных руд и концентратов.
Висмут получают сплавлением сульфида с железом:
Bi2S3 + 3Fe = 2Bi + 3FeS
При комнатной температуре в среде сухого воздуха не окисляется, но в среде влажного воздуха покрывается тонкой плёнкой оксида. Нагрев до температуры плавления приводит к окислению висмута, которое заметно интенсифицируется при 500 °C. При достижении температуры выше 1000 °C сгорает с образованием оксида Bi2O3
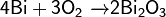
Взаимодействие озона с висмутом приводит к образованию оксида Bi2O5.
Незначительно растворяет фосфор. Водород в твердом и жидком висмуте практически не растворяется, что свидетельствует о малой активности водорода по отношению к висмуту. Известны гидриды Bi2H2 и BiH3, которые при нагреве являются неустойчивыми и ядовитыми газами. Висмут не взаимодействует с углеродом, азотом и кремнием.
Арсениды - соединения мышьяка с более электроположительными элементами.
Арсениды — кристаллические тугоплавкие соединения с металлическим блеском. Обладают полупроводниковой, полуметаллической или металлической проводимостью.
С увеличением атомного содержания мышьяка в молекуле химическая стойкость арсенидов увеличивается. При действии окислителей или при нагревании на воздухе арсениды окисляются до арсенатов(III) или до оксида мышьяка As2O3.
Арсениды получают чаще всего сплавлением As с соответствующим металлом в вакууме, инертной атмосфере, под давлением пара As или под слоем флюса.
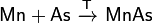
Антимони́ды — соединения сурьмы с металлами. Антимониды щелочных и в несколько меньшей степени щелочно-земельных металлов химически очень активны, легко окисляются, гидролизуются водой с выделением H3Sb. Антимониды Mg и Аl менее активны, но легко разлагаются разбавленными кислотами. Все остальные антимониды взаимодействуют только с концентрированными кислотами или царской водкой. С увеличением содержания Sb в антимонидах их химическая устойчивость повышается. Некоторые антимониды, в частности образуемые щелочными металлами, растворяются в солевых расплавах, например.
Получение: антимониды синтезируют сплавлением компонентов в вакууме или в инертной атмосфере, иногда под слоем флюса
При взаимодействии висмута с металлами образуются висмутиды, например, висмутид натрия (Na) Na3Bi, висмутид магния (Mg) Mg3Bi и др.
Висмутиды— твердые вещества, нерастворимые в органических растворителях. Хорошо растворяются в азотной и соляной кислотах, а также в расплавленных щелочах и хлоридах.
Получают висмутиды, как правило, сплавлением их компонентов.
 2018-01-21
2018-01-21 3948
3948








