Предположим, что мы имеем соединение АB. Оба элемента с большими значениями электроотрицательности ( ).
).
=> общая электронная пара в молекуле смещена от атома B к атому А. Электронейтральность нарушается, в молекуле появляются положительный (B) и отрицательный (A) полюса.
Такая система носит название диполь – полярная молекула (система из двух разноименных, одинаковых по величине зарядов, находящихся на малом расстоянии). Ковалентная связь – полярная.
Основная характеристика диполя – дипольный момент. 
 - напряженность поля, создаваемого диполем.
- напряженность поля, создаваемого диполем.
l – плечо диполя.
Примеры полярных молекул-диполей: 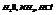 и др.
и др.
Чем больше плечо, тем полярнее молекула.
 можно представить как произведение некоторой величины D (единицы Дебая) на
можно представить как произведение некоторой величины D (единицы Дебая) на 
Для ионных соединений D=4-11 единиц, для полярных D=0-4 единиц.
Полярность связи – вектор, направленный от отрицательного полюса к положительному, происходит взаимное уничтожение векторов.
 2018-01-21
2018-01-21 854
854








