Характерен для водорода, галогенов и соединений «галоген+водород». Молекулы имеют линейчатую структуру. Химическая связь действует по кратчайшему расстоянию (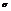 - сигма-связь).
- сигма-связь).
2. Молекулы типа 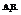
Характерен для соединений, образованных элементами главной подгруппы 6-ой группы: Н2О, Н2S.
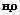 - валентный угол
- валентный угол 
 - валентный угол
- валентный угол 
3. Молекулы типа 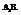
Характерен для соединений, образованных элементами главной подгруппы 5-й группы (N, P, As, Sb, Bi).
Молекула аммиака (NH3) имеет форму пирамиду с треугольным основании.
4. Молекулы типа 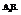
Главная подгруппа 4-й группы (Si,C,Ge,Sn, Pb)
Молекула метана имеет форму тетраэдра (по вершинам – атомы водорода, атом углерода – в центре).
5. Молекулы типа 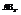
Главная подгруппа 3-ей группы (B,Al,Ga,In,Tl).
Молекула 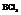 имеет вид равностороннего треугольника.
имеет вид равностороннего треугольника.
6. Молекулы типа 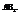
Характерен для некоторых соединений, образованными элементами главной подгруппы 2 группы.
ВеCl2 (линейная структура, угол – 180).
Если в молекуле имеется кратная связь между атомами (двойная или тройная), то только одна связь является прочной - пи-связь. Остальные – сигма-связи.
Пример. Рассмотрим молекулу этилена (С2Н4).
Имеет место неполная гибридизация 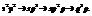
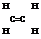
Между атомами углерода одна из связей «пи». Все остальне – «сигма».
Ионная связь.
В случае возникновения ионной связи между атомами или группами атомов преобладает электростатическое взаимодействие. Она возникает между атомами элементов, значительно отличающихся по величине электроотрицательности.
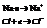
Элементы, входящие в состав ионного соединения, всегда существуют в виде ионов, а не нейтральных атомов. Также нужно отметить, что полного разделения зарядов нет и имеет место частичная ковалентность.
Валентность в ионных соединениях определяется по числу зарядов слагающих их ионов.
Ионы проводят электр. ток в растворах и расплавах и являются проводниками второго рода.
 2018-01-21
2018-01-21 902
902








