К.с. возникает между элементами с одинаковым или близким значением энергии сродства к электрону. Валентность атомов в соединениях с ковалентной связью определяется по числу электронных пар (одна пара – одна единица валентности).
Для оценки относительной зарядности элемента в ковалентных соединениях (хотя на самом деле никаких зарядов в этих соединениях нет) прибегают к приему: мысленно связь разорвать и руководствоваться следующим правилом: при разрыве связи в пределах периода электрон смещается от левее стоящего элемента к правее стоящего, а в пределах главной подгруппы от ниже стоящему к выше.
2 метода объяснения механизма возникновения ковалентной связи: метод валентных связей (МВС) и метод молекулярных орбиталей (МО).
В основе МВС лежит 3 положения: 1. Химическая связь образуется двумя электронами с противоположно направленными спинами. При этом имеет место взаимное перекрытие электронных орбиталей. Между атомами возникает зона повышенной электронной плотности, к которой притягиваются ядра с остальными электронами. 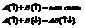
2. Связь имеет ориентацию в направлении, обеспечивающем максимально возможное перекрывание орбиталей.
3. Чем больше взаимное перекрывание электронных орбиталей, тем прочнее связь.
Валентными являются неспаренные электроны. Их число можно изобразить с помощью электронной конфигурации атомов.
При возбуждении атомов (за счет притока энергии извне) имеет место «распаривание» электронов и переход электрона на более удалённый подуровень в пределах одного уровня.
Распаривание одной электронной пары может увеличить валентность на 2 единицы.
Направленность ковалентной связи. Сигма и пи-связи. Гибридизация атомных орбиталей.
К.с. возникает между элементами с одинаковым или близким значением энергии сродства к электрону.
Перекрывание облаков при образовании к.с. возможно только при определенной их взаимной ориентации в пространстве – отсюда направленность связей, приводящая к определенной форме молекул. При этом область перекрывания располагается определенным образом по отношению к взаимодействующим атомам.
 2018-01-21
2018-01-21 626
626








