С разбавлением раствора степень диссоциации его увеличивается.
Выражает зависимость между 

Также можно установить связь и между 
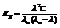
Сильные электролиты: почти все соли, большинство кислот и гидроксиды металлов.
Электролиты средней силы: 
Слабые электролиты: почти все органические кислоты, вода.
Гидролиз солей. Константа и степень гидролиза.
Гидролиз - разложение солей под действием воды.
Вторая формулировка. Процесс, обратный нейтрализации, приводящий к образованию кислоты и основания.
Нейтрализация – реакция между кислотой и основанием.
1. Гидролиза нет
-если сильное основание и сильная кислота.
-если нерастворимые вещества («н» в таблице).
Пример. 
2. Полный гидролиз
-если слабая кислота и слабое основание.
-если «-» в таблице растворимости.
Пример. 
3. 
-если сильное основание и слабая кислота.
-если слабое основание и сильная кислота.
Пример. 
Константа гидролиза: 
Степень гидролиза – применяется для характеристики реакций гидролиза.

Степень возрастает с ростом температуры и с уменьшением концентрации (разбавлением).
 2018-01-21
2018-01-21 1241
1241








