19)
Закон сохранения энергии - Энергия не может возникнуть из ничего и не может в никуда исчезнуть, она может только переходить из одной формы в другую
Первый закон термодинамики - Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
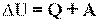
20)
Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплотфазовых переходов
.
Система – это совокупность взаимодействующих веществ, мысленно или фактически обособленная от окружающей среды (пробирка, автоклав).
Системы бывают: гомогенные – состоящие из одной фазы (однородный раствор поваренной соли) и гетерогенные – состоящие из нескольких фаз (вода со льдом).
Фаза – часть системы, однородная по составу и свойствам и отделенная от других частей системы поверхностью раздела.
Термодинамические свойства системы можно выразить с помощью нескольких функций состояния системы, называемых характеристическими функциями: внутренней энергии U, энтальпии H, энтропии S, энергии Гиббса G, энергии Гельмгольца F. Характеристические функции обладают одной особенностью: они не зависят от способа (пути) достижения данного состояния системы. Их значение определяется параметрами системы (давлением, температурой и др.) и зависит от количества или массы вещества, поэтому принято относить их к одному молю вещества.
Первый закон термохимии (Лавуазье и Лаплас, 1780—1784):
тепловой эффект образования данного соединения в точности равен, но обратен по знаку тепловому эффекту его разложения.
Q = ΔU + А.
Второй закон термохимии (Г. И. Гесс, 1840):
Тепловой эффект химической реакции не зависит от характера и последовательности отдельных ее стадий и определяется только начальными и конечными продуктами реакции и их физическим состоянием (при p=const или при v=const).
Следствия:
Следствие
Тепловой эффект химической реакции равен разности между суммами теплот (энтальпий) образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов в уравнении.
Для термохимических расчетов используют стандартные энтальпии образования веществ ΔfH0 – это изменение энтальпии в процессе образования 1 моля соединения в стандартном состоянии из простых веществ, тоже находящихся в стандартном состоянии в устойчивых формах и модификациях.
Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях, условно принимаются равными нулю.
Следствие
Важно для реакций, протекающих с участием органических веществ.
Тепловой эффект реакции равен разности между суммами теплот (энтальпий) сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
Теплота (энтальпия) сгорания – это тепловой эффект сгорания 1 моль органического вещества до СО2 и Н2О. Остальные продукты определяются конкретно для каждого случая.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
21)
2 закон термодинамики
В изолированных системах самопроизвольно протекают только те процессы, которые сопровождаются ростом энтропии системы.
Термодинамическая энтропия — термодинамическая функция, характеризующая меру неупорядоченности термодинамической системы, то есть неоднородность расположения и движения её частиц.
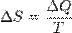
22)
· изобарические – при постоянном давлении;
· изохорические – при постоянном объеме;
· изотермические – при постоянной температуре;
· изобарно - изотермические – при постоянном давлении и температуре и т.д.
Энергия Гиббса образования веществ это изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых при 298 К.
Энергия Гиббса - это часть энергетического эффекта реакции, которую можно превратить в работу, поэтому ее называют свободной энергией. Это тоже термодинамическая функция состояния и, следовательно, для реакции.
Δ Н – энтальпийный фактор и Т Δ S - энтропийный фактор.
называется изменением энергии Гиббса (изобарно-изотермический потенциал)
Изобарно-изотермический потенциал и предсказание самопроизвольности протекания процессов.
-1.Стремление частиц объединиться в более сложные, что уменьшает энтальпию.
-2.Стремление частиц разъединиться, увеличить беспорядок, что увеличивает энтропию
Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянной температуре и постоянном давлении, отражает изменение изобарно-изотермического (или для краткости - изобарного) потенциала ΔG:
ΔG = ΔН – TΔS,
где ΔН - изменение энтальпии (теплосодержания системы), кДж/моль;
ΔS - изменение энтропии (меры беспорядка систем), Дж/моль•К;
T - температура, К.
Изобарный потенциал измеряется в ккал/моль или кДж/моль.
Характер изменений ΔG позволяет судить о принципиальной возможности или невозможности протекания процесса:
Если ΔG < 0, т. е. изобарный потенциал в ходе реакции уменьшается, то процесс возможен и, начавшись, он протекает самопроизвольно (спонтанно).
Если ΔG > 0, то невозможно осуществить процесс в данных условиях.
Если ΔG = 0, наблюдается состояние химического равновесия.
Термодинамические функции состояния: энергия Гиббса, энергия Гельмгольца. Критерий самопроизвольного протекания химических процессов в закрытых системах. Методы расчета изменения энергии Гиббса. Реакции при стандартных условиях.
23). Понятие о скорости реакции. Истинная и средняя скорость химической реакции.
Скорость химической реакции — изменение количества вещества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
истинная скорость (Мгновенная скорость) - это скорость в данный момент времени. Мгновенная скорость в ходе реакции все время снижается зависимость скорости от времени может быть самой различной.
Скорость гомогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объёма системы.
Скорость гетерогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности фазы.
24).факторы влияющие на скорость реакции
Факторы:
1. природа реагирующих веществ.
2. Концентрация.
3. Площадь соприкосновения реагирующих веществ (для гетерогенных реакций)
4. Температура
5. Катализатор
Закон действующих масс - устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
25). Правило Вант - Гоффа - эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции уравнение Аррениуса
Правило Вант – Гоффа. Повышение температуры ускоряет большинство химических реакций. Согласно эмпирическому правилу Вант- Гоффа при повышении температуры на 10 К скорость многих реакций увеличивается в 2 – 4 раза
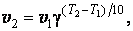
Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоуль моль), чтобы произошла реакция.
Раздел химии, изучающий скорости и механизмы химических реакций, называется химической кинетикой.
Уравнение Аррениуса:
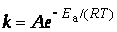 ,
,
Уравнение Аррениуса позволяет рассчитывать константы скорости (и скорости) при различных температурах.
Аррениус предположил, что реагировать между собой могут только те молекулы, которые находятся в активной форме, образующиеся из обычных молекул. Такие молекулы были названы активными, а энергия, необходимая для перевода обычных молекул в активное состояние, энергией активации.
26)
Катализаторы – вещества, не расходующиеся в результате протекания реакции и не входящие в состав конечных продуктов реакции, но увеличивающие скорость реакции. Катализаторы могут участвовать в образовании промежуточных продуктов реакции, но к концу реакции они полностью регенерируются.
Явление изменение скорости под действием катализатора называется катализом, а реакции - каталитическими.
Теория каталитических реакций основана на следующих положениях:
а) катализ применим для реакций, в которых для данных условий энергия Гиббса отрицательна (G < 0);
б) в присутствии катализатора изменяется механизм реакции, она протекает через новые стадии с невысокой энергией активации;
в) при катализе не изменяется тепловой эффект реакции;
г) для обратимых реакций катализатор не влияет на равновесие, не меняет константы равновесия и равновесных концентраций;
д) катализатор действует селективно (избирательно).
 2018-01-21
2018-01-21 403
403








