относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества Δ р/р0 = n/(n + N),
где n – число молей растворенного вещества; N – число молей растворителя.
Из закона Рауля возникают два следствия.
Первое следствие из закона Рауля.
Повышение температуры кипения Δ Т кип пропорционально моляльности раствора С m.
Δ Т кип. = К э С m,
где К э – эбуллиоскопическая постоянная растворителя;
Сm – моляльная концентрация раствора;
Δ Т кип. = Т кип р-ра – Т кип.р-рителя.
Повышение температуры кипения обусловлено тем, что давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя.
Второе следствие из закона Рауля.
Температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя.
Это обусловлено более низким давлением пара растворителя над раствором, чем над чистым растворителем. Понижение температуры замерзания (кристаллизации) Т зампропорционально моляльности раствора
Δ Т зам = К к С m,
где К к – криоскопическая постоянная, зависящая от природы растворителя.
Используя эти уравнения можно определить молярную массу вещества по повышению температуры кипения раствора (метод эбуллиоскопии) или по понижению температуры замерзания раствора (метод криоскопии). Для этого экспериментально определяют повышение температуры кипения или замерзания раствора. Если известна масса растворенного вещества m B и растворителя m A, то молярную массу растворенного вещества М В определяют по уравнению
Мв = 103КmB/(mAΔT).
Смос. Закон Вант-Гоффа. Процесс самопроизвольного перехода растворителя
(диффузия) через полупроницаемую мембрану, называемый осмосом.
Давление, которое необходимо приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением. Если давление, приложенное к более концентрированному раствору, больше осмотического, то растворитель будет переходить из раствора в растворитель. Процесс носит название обратный осмос и используется для очистки природных и сточных вод, в частности, может быть использован для водоподготовки в теплоэнергетике.
Зависимость осмотического давления от температуры и концентрации описывается уравнением:
π = с(В)RT, (7.11)
где π – осмотическое давление; с(В) – молярная концентрация растворенного вещества, моль/л; R – универсальная газовая постоянная; T – температура, К.
Закон Вант-Гоффа: осмотическое давление равно тому давлению,которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объем, который занимает раствор.
Из закона Вант-Гоффа следует, что растворы различных неэлектролитов одинаковой концентрации, находящиеся при одинаковой температуре являются изотоническими, т.е. имеющими одинаковое осмотическое давление.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
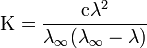
Здесь К — константа диссоциацииэлектролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
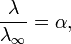
где α — степень диссоциации.
37) Ио́нное произведе́ние воды́ — произведение концентрацийионовводорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
Водоро́дный показа́тель, pH (произносится «пэ аш», английское произношение англ. pH — piː'eɪtʃ «Пи эйч») — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионовводорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифмактивности водородных ионов, выраженной в молях на литр:
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества- красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы.
По аналогии с рН был введен и гидроксильный показатель рОН, определяемый через значение рН. например, если рН = 4, то рОН = 14 — 4= 10.
Постоянство рН биологических жидкостей является необходимым условием нормального течения биохимических процессов в организме. Оно обеспечивается специальными гомеостатическими системами (см. Гомеостаз). Особое значение для жизнедеятельности организма имеет устойчивость активной реакции крови, поддерживаемая на уровне рН = 7,33—7,47 (см. Кислотно-щелочное равновесие). Небольшие изменения рН крови за пределами указанных границ (рН < 7,33 и > 7,44) свидетельствуют о серьезных нарушениях физиологических и физико-химических механизмов компенсации, ведущих к развитию Алкалоз а или Ацидоз а. Значения рН крови ниже 6,8 и выше 7,8 несовместимы с жизнью.
38) БУФЕРНЫЕ РАСТВОРЫ – растворы, концентрация ионов водорода (рН) которых не изменяется от прибавления ограниченных количеств сильной кислоты или щелочи (см. водородный показатель). Б.р. состоят из смеси раствора слабой кислоты и ее соли сильного основания или, наоборот, — слабого основания и его соли сильной кислоты.
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Значение pH буферного раствора можно рассчитать по формуле: 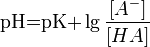 , где
, где 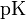 это отрицательный десятичный логарифм от константы диссоциации кислоты
это отрицательный десятичный логарифм от константы диссоциации кислоты 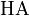
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество.
39) Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Гидролиз, дословно, - это разложение водой. Давая такое определение реакции гидролиза солей, мы подчеркиваем, что соли в растворе находятся в виде ионов, и что движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах).
 2018-01-21
2018-01-21 464
464








