Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные (унидентатные) лиганды, связанные с центральным атомом через один из своих атомов, то есть одной ковалентной связью), бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя связями), три-, тетрадентатные и т. д.
Координационный полиэдр — воображаемый молекулярный многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах — частицы лигандов, непосредственно связанные с центральным атомом.
Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
|
|
|
По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)
1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион.
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.
|
|
|
4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.
5) После обозначения состава внутренней сферы называют внешнюю сферу.
6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
Примеры:
K3[Fe(CN)6] — гексацианоферрат(III) калия
(NH4)2[PtCl4(OH)2] — дигидроксотетрахлороплатинат(IV) аммония
[Сr(H2O)3F3] — трифторотриаквахром
[Сo(NH3)3Cl(NO2)2] — динитритохлоротриамминкобальт
[Pt(NH3)4Cl2]Cl2 — хлорид дихлоротетраамминплатины(IV)
[Li(H2O)4]NO3 — нитрат тетрааквалития
30)
Согласно методу валентных связей (ВС) между комплексообразователем и лигандами возникает ковалентная связь по донорно-акцепторному механизму.
Рассмотрим образование комплексного соединения из 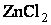 и аммиака NH3:
и аммиака NH3:
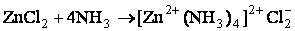
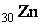
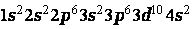
Электронная формула иона цинка
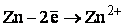 : 1 s 22 s 22 p 63 s 23 p 63 d 104 s 04 p 0
: 1 s 22 s 22 p 63 s 23 p 63 d 104 s 04 p 0
Ион цинка имеет свободные атомные орбитали 4 s и 4 p и является акцептором. Атомные орбитали неравноценны и подвергаются гибридизации, с образованием четырех равноценных гибридных орбиталей.
У атома азота в молекуле аммиака имеется неподеленная пара электронов, и он служит донором:
:N-H.
При их взаимодействии Zn2+ и 4NH3 образуется комплексный ион [Zn(NH3)4]2+. Так как, атомные орбитали цинка подвергались sp 3-гибридизации, то комплексный ион будет иметь тетраэдрическое строение.
При образовании донорно-акцепторной связи в комплексах могут использоваться: s-, p-, d - орбитали. Если гибридизации подвергаются s - и p - орбитали, то наблюдается sp -гибридизация, которая приводит к образованию линейной структуры комплекса с координационным числом комплексообразователя равным 2. -[Ag(NH3)2]+. Если у комплексообразователя участвуют в гибридизации s и 2 р атомные орбитали (sp 2-гибридизация), то образуется плоская треугольная структура комплекса. При sp 2 d – гибридизации структура образующегося комплекса – квадратная, координационное число равно 4. При sp 3 d 2 – гибридизации структура комплекса октаэдрическая, координационное число равно 6 и т.п.
Метод ВС позволяет предсказать состав, структуру комплекса, магнитные и оптические свойства.
Если в комплексе все электроны спарены, то свойства комплекса - диамагнитные (выталкивается из магнитного поля), если имеются неспаренные электроны, то свойства комплекса парамагнитные (втягивается в магнитное поле).
Окраска комплексных соединений зависит от типа лигандов и комплексообразователя. Из-за расщепления энергии d - орбиталей в октаэдрическом поле лигандов появляется возможность перехода электронов с низкоэнергетических d – подуровней на уровни с более высокой энергией. При этом комплексы поглощают кванты света определенных диапазонов длин волн и имеют соответствующую окраску.
Таким образом, метод ВС позволяет объяснить механизм образования химических связей и свойства комплексных соединений.
31) В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.
Первичная диссоциация комплексного соединения - это его распад на комплексный ион, образованный внутренней сферой и ионы внешней сферы. В водных растворах первичная диссоциация комплексных соединений обусловлена разрывом ионной связи между внутренней и внешней сферами, она практически необратима:
K3[Fe(CN)6] ® 3K+ + [Fe(CN)6]3–
Na[Al(OH)4] ® Na+ + [Al(OH)4]–
[Cu(NH3)4]SO4 ® [Cu(NH3)4]2+ + SO42–
[Pt(NH3)4Cl2]Cl2 ® [Pt(NH3)4Cl2]2+ + 2Cl–
Образующийся комплексный ион ведет себя как целая самостоятельная частица с характерными для нее свойствами. Поэтому в водных растворах комплексных соединений, как правило, нельзя обнаружить присутствие ионов или молекул, входящих в состав внутренней сферы. В растворе красной кровяной соли нельзя обнаружить присутствие ионов Fe3+ и CN–, а в 1М растворе хлорида дихлоротетраамминплатины(IV) [Pt(NH3)4Cl2]Cl2 обнаруживается только присутствие 2 моль хлорид-ионов, а не 4 моль.
|
|
|
Но насколько устойчива внутренняя сфера комплекса? Может ли происходить отщепление лигандов от комплексообразователя? Действительно, это возможный процесс, он называется вторичной диссоциацией комплексного соединения.
Вторичная диссоциация комплексного соединения – это распад внутренней сферы комплекса на составляющие ее компоненты.
Так как при этом разрушаются не ионные, а ковалентные связи комплексообразователя с лигандами, этот процесс затруднен и обратим. Он происходит ступенчато:
[Ag(NH3)2]+? [Ag(NH3)]+ + NH3 1-ая ступень
[Ag(NH3)]+? Ag+ + NH3 2-ая ступень
Вторичная диссоциация характеризуется константой равновесия, причем для каждой из стадий можно вычислить свою константу. Для количественной оценки устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию. Эту константу называют константой нестойкости комплекса Кнест. В соответствии с законом действующих масс для приведенного нами выше примера диссоциации иона диамминсеребра выражение для константы нестойкости принимает вид:
Чем ниже Kнест, тем прочнее и стабильнее внутренняя сфера комплексного соединения, тем в меньшей мере происходит вторичная диссоциация комплексного соединения в растворе.
При растворении в воде комплексных соединений, обычно они распадаются на ионы внешней и внутренней сфер подобно cильным электролитам, так как эти ионы связаны ионогенно, в основном, электростатическими силами. Это оценивается как первичная диссоциация комплексных соединений.
K [ Ag(CN) 2 ] ® К + + [ Ag(CN) 2 ] —
Вторичная диссоциация комплексного соединения – это распад внутренней сферы на составляющие ее компоненты. Этот процесс протекает по типу слабых электролитов, так как частицы внутренней сферы связаны неионогенно (ковалентной связью). Диссоциация носит ступенчатый характер:
|
|
|
  [Ag(CN)2]— [AgCN] + CN— [Ag(CN)2]— [AgCN] + CN— | 1 ступень |
  [AgCN] Ag+ + CN— [AgCN] Ag+ + CN— | 2 ступень |
Диссоциация комплексных ионов имеет количественную характеристику – константу нестойкости (Кн):
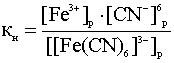
Чем больше величина этой константы, тем сильнее комплекс диссоциирует, тем менее он устойчив. Эта константа называется константой нестойкости. Обратная величина константы нестойкости называется константой устойчивости:
32) Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. "Гомогенный" - значит, каждый из компонентов распределён в массе другого в виде своих частиц, то есть атомов, молекул или ионов.[1].
Раствор — однофазная система переменного, или гетерогенного, состава, состоящая из двух или более компонентов.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает
Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе
 2018-01-21
2018-01-21 2500
2500
