Генетическая связь между классами неорганических веществ – это связь между веществами, которые относятся к разным классам.
Основные признаки генетических рядов:
1. Все вещества одного ряда должны быть образованы одни химическим элементом.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам химических веществ.
3. Вещества, образующие генетический ряд элемента, должны быть связаны между собой взаимопревращениями.
Таким образом, генетическим называют ряд веществ, которые представляют разные класс неорганических соединений, являются соединениями одного и того же химического элемента, связаны взаимопревращениями и отражают общность происхождения этих элементов.
3) Оксиды – это сложные вещества, состоящие из двух элементов один из которых является кислород, играющий более электроотрицательную роль.
Классификация: Солеобразующие (основные, кислотные, амфотерные), несолеобразующие.
Основные оксиды – оксиды, взаимодействующие с кислотами или кислотными оксидами с образованием солей. (MgО)
Кислотные оксиды - оксиды, взаимодействующие с основаниями или с основными оксидами с образованием солей. (SO3)
Амфотерные – оксиды, взаимодействующие как с кислотами, так и с основаниями. (Al2O3)
НЕСОЛЕОБРАЗУЮЩИЕ – оксиды, не способные взаимодействовать с кислотами или основаниями с образованиям солей. (NO)
Безразличны к ним.
Вывод: характер свойств оксидов в первую очередь зависти от валентности элемента:
CrO (II - основный)
Cr 2O3 (III - амфотерный)
CrO3 (VII – кислотный)
Физические свойства оксидов:
При комнатной температуре большинство оксидов - твердые вещества (СаО, Fe2O3 и др.), некоторые - жидкости (Н2О, Сl2О7 и др.) и газы (NO, SO2 и др.).
Химические свойства:
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO2 = CaSO3
2. Основной оксид + Кислота = Соль + Н2О (р. обмена)
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
3. Основной оксид + Вода = Щёлочь (р. соединения)
Na2O + H2O = 2NaOH
4 Кислотный оксид + Вода = Кислота (р. соединения)
СO2 + H2O = H2CO3, SiO2 – не реагирует
5. Кислотный оксид + Основание = Соль + Н2О (р. обмена)
P2O5 + 6KOH = 2K3PO4 + 3H2O
6. Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO2 = CaSO3
7. Менее летучие вытесняют более летучие из их солей
Амфотерные оксиды - Взаимодействуют как с кислотами, так и со щелочами.
4) Основания – это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксидгруппами.
-Щелочи
-Нерастворимы в воде
К щелочам относят гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.Остальные - нерастворимые.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью - как кислоты.
| Щёлочи | Нерастворимые основания |
| 1.Взаимодействие с кислотами | |
| KOH+HCl=KCl+H2O | Cu(OH)2+2HCl=CuCl2+2H2O |
| 2.Взаимодействие с кислотными оксидами | |
| 2KOH+CO2=K2CO3+H2O | не характерны |
| 3.Действие индикаторов | |
| лакмус-синяя, фенолфталеин-малиновая | окраска не изменяется |
| 4.Взаимодействие с амфотерными оксидами | |
| 2KOH+ZnO=K2ZnO2+H2O | не реагируют |
| 5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание | |
| NaOH+CuCl2=Cu(OH)2=2NaCl | не реагируют |
| 6.При нагревании | |
| не разлагаются(кроме LiOH) | Cu(OH)2=CuO+H2O |
| Амфотерные гидроксиды(Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3 и другие. | |
| Взаимодействуют с кислотами Zn(OH)2+2HCl=ZnCl2+2H2O | Взаимодействуют с щелочами Al(OH)3+NaOH=Na[Al(OH)4] |
5) Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
Классификация: По их силе, по основности и по наличию или отсутствие кислорода в составе кислоты.
Названия кислородных кислот производятся от названия неметалла с прибавлением окончаний –ная, -вая, если степень окисления его соответствует номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая:
|
|
Физические свойства - Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорнаяHPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Химические свойства:
| Название индикатора | Нейтральная среда | Кислая среда |
| Лакмус | Фиолетовый | Красный |
| Фенолфталеин | Бесцветный | Бесцветный |
| Метилоранж | Оранжевый | Красный |
| Универсальная индикаторная бумага | Оранжевая | Красная |
.Реагируют с металлами в ряду активности до H2
(искл. HNO3 –азотная кислота)
3. С основными (амфотерными) оксидами – оксидами металлов
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O (р. обмена)
5. Реагируют с солями слабых, летучих кислот - если образуется соль, выпадающая в осадок или выделяется газ:
| Сила кислот убывает в ряду: HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3. Каждая предыдущая кислота может вытеснить из соли последующую |
6. Разложение кислородсодержащих кислот при нагревании
(искл. H2SO4; H3PO4)
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА
6) Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
7) Атом - система взаимодействующих элементарных частиц, состоящая из положительно заряженного ядра и электронов.
Результаты опыта Резерфорда объяснил, предложим «планетарную» модель атома, уподоблявшую его солнечной системе. Согласно планетарной модели в центре атома находится очень маленькое ядро, размеры которого приблизительно в 100000 раз меньше самого ядра. Это ядро заключает в себя почти всю массу атома и несет положительный заряд. Вокруг ядра движутся электроны, число которых определяется зарядом ядра. Внешняя троектория движения электронов определяет внешние размеры атома. Диаметр атома – величина порядка м, а диаметр ядра.
Два противоречия:
1) Планетарная модель атома не могла объяснить устойчивости атома. По сути, электрон двигаясь должен испускать электромагнитную энергию в виде световых волн. Но электрон излучая свою энергию, что приводит к равновесию между центробежной силой, связанная с вращением атома и силой электростатического притяжения электрона к ядру. Электрон теряя свою энергию, должен по спиральной траектории упасть на ядро и атом прекратит своё существование.
2) Планетарная теория строения атома не смогла объяснить линейчатый спектр испускания атомов водорода и тем более объединение спектра в серии.
Спектр испускания – совокупность частот электромагнитного излучения, испускаемого веществами.
Спектр поглощения – вещества поглощают излучение определенных частот. Совокупность.
8) Основные положения своей теории Бор сформулировал в виде трех постулатов (постулат утверждение, принимаемое без доказательств):
1. Электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбита. Эти орбиты получили названия – стационарные.
2. Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
3. Излучение происходит при скачкообразном переходе электрона с одно стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состояниях.
Квантово-волновой дуализм электрона.
1)Электрон- это частица
А) электрон имеет массу 9,13*10^-31 кг
Б)любая частица имеет заряд,электрон имеет самый маленький заряд.
В)Отклонение электрона в электромагнитном поле.
2) электрон- это волна
А) дифракция (огибание)
Б) интерференция (разложение на составляющие)
Следствием волнового харак. Движения электрона в атоме, является квантованность.
9) Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
1. Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3,...)
2. Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n -1(l = 0, 1, 2, 3,..., n -1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s -орбиталями,
l = 1 – р -орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 – d -орбиталями (5 типов),
l = 3 – f -орбиталями (7 типов).
3. Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от + l до - l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р -АО: р x, р y, р z.
4. Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы: 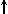 и
и 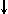 .
.
10) Правило Клечковского – Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел. При одинаковой сумме раньше заполняется орбиталь с меньшим значением n.
Принцип Паули – В атоме не может быть электронов, имеющих одинаковый набор всех четырех квантовых чисел.
Правило Хунда – В наиболее устойчивом состоянии атома электроны размещаются в пределах электронной подоболочки так, чтобы их суммарный спин был максимален. Сначала электроны по одному заполняют квантовую ячейку, а когда нет места, электроны спариваются.
11) Периодический закон – Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
а) в периодах слева направо с ростом заряда ядра атомов металлические свойства элементов ослабевают, а неметаллические усиливаются;
б) в группах сверху вниз с ростом заряда ядра атомов металлические свойства элементов усиливаются, а неметаллические ослабевают
Периодический закон- свойства простых веществ,а также образуемых или сложных веществ находится в периодической зависимости от заряда ядер их атомов. Короткий вариант периодической системы состоит из периодов,рядов и групп,по горизонтали имеется 7 периодов:1,2,3 назыв. Малыми, 4,5,6 назыв. Большими,а 7 незавершённый. По вертикали располож. 8 групп,каждая делится на главную и побочную,что отображается смещением в лево и вправо. Периодичность изменения свойств элементов. Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома.
Электронные семейства
s-элементы.у них заполняется s подуровень внешнего энергетич. Уровня. Они расположены вначале каждого периода.
p-элементы,у них заполн. p Подуровни внеш. Энерг. Уров.распологаются со 2-го по 6-ой период
d-элемент,у них заполняется d подуровень предвнешнего энергитич.уров.и они образ. Вставные декады элементов между s и p элементами начинаяс 4 по 7 периоды.
f-элемент,у них заполняется f подуровень 2-го снаружи энергитич. Уровня.
12)
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами.
Типы связи:
-Ковалентная (полярная, неполярная)
-Ионная
-Металлическая
-Водородная
Характеристики:
ЭНЕРГИЕЙ СВЯЗИ называют ту энергию, которую необходимо затратить для ее разрыва. При этом молекула должна находиться в основном (невозбужденном) состоянии и при 0оК. Эта величина определяет прочность связи. Чем больше энергия, затрачиваемая на разрыв связи, тем прочнее связь. Единица измерения энергии связи — кДж/моль.
ДЛИНОЙ СВЯЗИ называют среднее расстояние между ядрами, отвечающее минимуму энергии системы.
ВАЛЕНТНЫЕ УГЛЫ. Это углы между связями в молекуле. Их схематически можно представить как углы между прямыми линиями, соединяющими ядра атомов в молекуле. Эти воображаемые прямые, проведенные через два ядра, называют линиями связи. Величины валентных углов зависят от природы атомов и характера связи. Простые двухатомные молекулы всегда имеют линейную структуру. Трехатомные и более сложные молекулы могут обладать различными конфигурациями. Например, в молекуле воды угол между линиями связи Н—О равен 104,5°, а в сходной молекуле сероводорода валентный угол между связями составляет 92°.
Виды:
-Короткодействующая
-Дальнодействующая
13)
Ковалентная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений
-Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
-Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
-Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
-Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
-Электроны тем подвижнее, чем дальше они находятся от ядер. Ковалентная связь это когда два атома делятся электронами и держатся вместе.
К обменному механизму относят случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. Например водород: Н2 Н. +Н. →Н:Н или Н-Н. Связь возникает благодаря образованию общей электронной пары за счет объединения неспаренных электронов. У каждого атома есть по одному s –электрону. Атомы Н равноценны и пары одинаково принадлежат обоим атомам. По этому же принципу происходит образование общих электронных пар (перекрывание р-электронных облаков) при образовании молекулы Сl2. При образовании молекулы N2 Образуются 3 общие электронные пары. Перекрываются р-орбитали. Связь называется неполярная.
При образовании молекулы хлороводорода перекрывается орбиталь s-электрона водорода и орбиталь р-электрона хлора Н-Сl. Связывающая электронная пара смещена к атому хлора, в результате чего образуется диполь, который измеряется дипольным моментом. Связь называется полярная.
По донорно-акцепторному механизму происходит образование иона аммония. Донор (азот) имеет электронную пару, акцептор – (Н+) свободную орбиталь, которую пара электронная азота может занять. В ионе аммония три связи азота с водородом образованы по обменному механизму, а одна по донорно-акцепторному. Все 4 связи равноценны.
Ковалентные связи классифицируют не только по механизму образования общих электронных пар, соединяющих атомы, но и по способу перекрывания электронных орбиталей, по числу общих пар, а также по смещению их. По способу перекрывания – σ (сигма s- s, s-р, р-р) π (р-р гантели перекрываются двумя местами). В молекуле азота между атомами существуют одна σ-связь и две π-связи, которые находятся в двух взаимно перпендикулярных плоскостях.
14) Пи-связь (π-связь) — ковалентная связь, образующаяся перекрыванием p-атомных орбиталей. В отличие от сигма-связи, осуществляемой перекрыванием s-атомных орбиталей вдоль линии соединения атомов, пи-связи, возникают при перекрывании p-атомных орбиталей по обе стороны от линии соединения атомов. Считается, что пи-связь реализуется в кратных связях — двойная связь состоит из одной сигма- и одной пи-связи, тройная — из одной сигма- и двух ортогональных пи-связей.
1. В образовании связи участвуют только электроны внешней электронной оболочки атома (валентные электроны).
2. Химическая связь образуется двумя валентными электронами различных атомов с антипараллельными спинами. При этом происходит перекрывание электронных орбиталей и между атомами появляется область с повышенной электронной плотностью, обусловливающая связь между ядрами атомов. Таким образом, в основе МВС лежит образование двухэлектронной, двухцентровой связи.
3. Химическая связь осуществляется в том направлении, в котором обеспечивается наибольшее перекрывание атомных орбиталей.
4. Из нескольких связей данного атома наиболее прочной будет связь, которая получилась в результате наибольшего перекрывания атомных орбиталей.
5. При образовании молекул электронная структура (кроме внешней электронной оболочки) и химическая индивидуальность каждого атома в основном сохраняются.
Известны два механизма образования общих электронных пар: обменный и донорно-акцепторный.
15) Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Гибридизация – это явление смешения АО или электронных облаков, приводящее к образованию новых гибридных облаков одинаковой формы и одинаковой энергии.
| Тип гибридизации | Число гибридных орбиталей | Геометрия | Структура | Примеры |
| sp | Линейная | 
| BeF2, CO2, NO2+ | |
| sp2 | Треугольная | 
| BF3, NO3-, CO32- | |
| sp3 | Тетраэдрическая | 
| CH4, ClO4-, SO42-, NH4+ | |
| dsp2 | Плоскоквадратная | 
| Ni(CO)4, XeF4 | |
| sp3d | Гексаэдрическая | 
| PCl5, AsF5 | |
| sp3d2 | Октаэдрическая | 
| SF6, Fe(CN)63-, CoF63- |
16)
 2018-01-21
2018-01-21 834
834







