какой – либо раствор, называется электродным потенциалом металла
Равновесный потенциал электрода при стандартных условиях, измеренный относительно стандартного водородного электрода, носит название стандартного электродного потенциала
1. Чем левее в ряду находится металл, тем он химически активнее, тем металл легче окисляется и труднее восстанавливаются его ионы.
2. Каждый металл этого ряда, не разлагающий воду, вытесняет (восстанавливает) следующие за ним металлы из растворов их солей.
3. Все металлы, стоящие в ряду напряжений левее водорода, вытесняют (восстанавливают) его из разбавленных кислот типа серной или соляной, анионы которых не проявляют окислительных свойств; стоящие правее водорода, его не вытесняют.
4. Чем дальше расположены два металла в ряду друг от друга, тем большее значение ЭДС будет иметь составленный из них гальванический элемент.
Вопрос №29 Водородный электрод. Устройство и электродные процессы. Стандартный водородный электрод. Зависимость величины потенциала водородного электрода от рН среды.
|
|
|
Измеряют относительную величину электродного потенциала, сравнивая его с потенциалом электрода, выбранного в качестве эталона.
В качестве такого электрода, называемого электродом сравнения, часто используют стандартный водородный электрод.
Водородный электрод состоит из платиновой пластинки, покрытой платиновой чернью (электролитически осажденной платиной), которая абсорбирует продуваемый через электрод газообразный водород. Пластина погружена в раствор кислоты.
На электроде устанавливается равновесие:
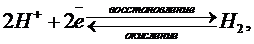
Водородный электрод, находящийся при стандартных условиях ([Н+] = 1 моль/л, Р0 = 101,3 кПа), называют стандартным водородным электродо м, а потенциал такого электрода условно принят за ноль при любой температуре. Условная запись водородного электрода:
Pt, H2/H2SO4.
рН влияет на величину равновесного потенциала.
Это означает, что при изменении рН на единицу потенциал водородного электрода уменьшается на 59 мВ.
Чем кислее раствор, тем большую величину имеет потенциал водородного электрода.
Вопрос №30 Гальванические элементы. Как можно практически определить электродный потенциал металла? От каких факторов зависит величина электродных потенциалов? Уравнение Нернста. Уравнение Нернста для металлических электродов при стандартных условиях.
Для определения величины стандартного электродного потенциала медного электрода составляют гальванический элемент – устройство, состоящее, как минимум, из двух электродов, в котором химическая энергия превращается в электрическую.
|
|
|
Величина φ зависит прежде всего от того, насколько прочно связаны ион-атомы в кристаллической решетке металла. Прочность связи в кристаллической решетке характеризуется энергией кристаллической решетки. Чем больше энергия кристаллической решетки, тем менее возможен выход иона в раствор. Величина электродного потенциала зависит и от энергии гидратации катионов. Чем эта энергия больше, тем больше вероятность перехода иона металла в раствор из кристаллической решетки.
(Потенциалы зависят от активности Ме в растворе.Потенциалы будут определяться активностью(концентрацией)анионов в растворе)
Зависимость потенциала от концентрации ионов соли в растворе выражается формулой Нернста.
Потенциалы электродов при условиях, отличающихся от стандартных, можно расчитать по уравнению Нернста:
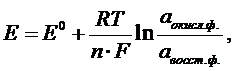
где: Е -потенциал электрода при условиях, отличающихся от стандартных, В;
Е0 -стандартный электродный потенциал, В;
R -универсальная газовая постоянная, равная 8,314 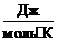 ;
;
F -число Фарадея, равное 96500 Кл/моль;
n -число электронов, принимающих участие в окислительно-восстановительном процессе;
a окис.ф. -активность окисленной формы, моль/л;
a восст.ф . -активность восстановительной формы, моль/л;
Для металлических электродов, находящихся в разбавленных растворах при ст.усл.:
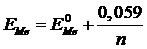 lg
lg 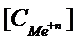 ,
,
Вопрос №31 Типы гальванических элементов. Химические, концентрационные и термогальванические элементы. Э.Д.С. гальванических элементов. Приведите примеры. Укажите процессы, протекающие на электродах, и рассчитайте ЭДС медно-цинкового химического гальванического элемента.
 2018-01-21
2018-01-21 539
539








