Процесс гидролиза проходит полнее при разбавлении раствора, так как увеличивается концентрация воды.
Степень гидролиза – это отношение числа молекул, подвергшихся гидролизу (N) к общему числу молекул в растворе (N 0):
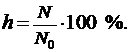

Если соль образована слабым основанием

Если соль образована слабым основанием и слабой кислотой
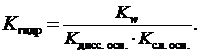
Из приведенных формул следует, что чем слабее электролит, образовавший соль, тем больше значение константы гидролиза и тем глубже протекает процесс гидролиза.
Необратимому гидролизу подвергаются солеобразные бинарные соединения металлов (карбиды, нитриды и др.), а также некоторые галогениды металлов и неметаллов.
Вопрос №25 Окислительно-восстановительные реакции. Степень окисления элемента. Окислитель и восстановитель. Процессы окисления и восстановления. Приведите примеры типичных окислителей и восстановителей. Какие процессы представляют собой процессы окисления, а какие восстановления:
S-2 →S0 Cr2O72- → Cr+3 Mg0 → Mg+2 O2 +2H2O → 4OH-
Окислительно-восстановительные реакции – это реакции, протекающие с изменением степеней окисления атомов элементов, входящих в состав молекул реагирующих веществ:
степень окисления – это условный заряд атома в молекуле, возникающий исходя из предположения, что электроны не смещены, а полностью отданы атому более электроотрицательного элемента.
Процесс окисления – это процесс отдачи электронов атомом, молекулой или ионом; при этом степень окисления увеличивается, а вещество является восстановителем:
 – 2ē ® 2H+ процесс окисления,
– 2ē ® 2H+ процесс окисления,
Fe+2 – ē ® Fe+3 процесс окисления,
2J– – 2ē ®  процесс окисления.
процесс окисления.
Процесс восстановления – это процесс присоединения электронов, при этом степень окисления уменьшается, а вещество является окислителем:
 + 4ē ® 2O–2 процесс восстановления,
+ 4ē ® 2O–2 процесс восстановления,
Mn+7 + 5ē ® Mn+2 процесс восстановления,
Cu+2 +2ē ® Cu0 процесс восстановления.
Окислитель – вещество, которое принимает электроны и при этом восстанавливается (степень окисления элемента понижается).
Восстановитель – вещество, которое отдает электроны и при этом окисляется (степень окисления элемента понижается).
Типичными восстановителями являются:
· некоторые простые вещества:металлы: например, Na, Mg, Zn, Al, Fe;неметаллы: например, H2, C, S;
· некоторые сложные вещества: например, сероводород (H2S) и сульфиды (Na2S), сульфиты (Na2SO3), галогеноводороды (HJ, HBr, HCI)
· катионы металлов в низших степенях окисления: например, SnCl2, FeCl2, · катод при электролизе.
Типичными окислителями являются:
· некоторые простые вещества – неметаллы: например,галогены (F2, CI2, Br2, I2), халькогены (О2, О3, S);· некоторые сложные вещества: азотная кислота
· анод при электролизе.
Вопрос № 26 Классификация окислительно-восстановительных реакций. Приведите примеры реакций каждого типа. Составьте уравнения соответствующих реакций с помощью метода электронного баланса.

Вопрос №27 Характер взаимодействия металлов с водой, растворами солей, щелочей и кислот. Особенности взаимодействия металлов с концентрированной серной кислотой и азотной кислотой. Как реагирует железо с сильно разбавленной, разбавленной и концентрированной азотной кислотой? Составьте уравнения соответствующих реакций.
1)Взаимодействие кислот с металлами есть окислительно-восстановительный процесс. Окислителем является ион водорода, который принимает ионы от металла.
2)Взаимодействие металлов с растворами солей менее активных металлов можно иллюстрировать примером действия железа на раствор сульфата меди. В этом случае происходит отрыв электронов от атомов более активного металла (железа) и присоединение их ионами менее активного (меди).
3) Активные металлы взаимодействуют с водой,которая выступает в роли окислителя.
При взаимодействии металлов с концентрированной серной кислотой следует иметь в виду, что окислителем является сульфат-анион SO42–. А не ион Н+, Так, в случае неактивного металла (Ео>–0,5 В) сера восстанавливается до +4 (SO2), а в случае активного металла (Ео < –0,5 В) сера восстанавливается до 0 (S) или –2 (H2S).
. Реакция концентрированной серной кислоты с цинком. Так как для цинка Ео=–0,763 В, значит, сульфат–анион SO42– способен восстанавливаться до H2S.
Реакция будет протекать по схеме:
Fe + H2SO42– → FeSO4 + H2S + H2O,:
Fe–2e→Fe2+ процесс окисления, восстановитель
S+6 +8e→ S-2 процесс восстановления, окислитель
Взаимодействие металлов с разбавленной и концентрированной азотной кислотой. В азотной кислоте окислителем является нитрат – анион NO3–. Характерная особенность азотной кислоты состоит в том, что при её действии на металлы обычно не происходит выделения газообразного водорода. При восстановлении нитрат –аниона степень окисления азота уменьшается с +5 до +4, +3, +2, +1, 0, или даже –3. При этом образуются различные оксиды азота или нитрат аммония. Степень окисления азота также зависит от концентрации кислоты и активности металла.


Вопрос №28 Возникновение скачка потенциала на границе металл - раствор соли металла. Стандартный электродный потенциал. Ряд стандартных электронных потенциалов металлов. Какие выводы можно сделать исходя из положения металла в ряду?
На границе раздела фаз возникает скачок электрического потенциала. Возникновение скачка потенциала вызывается различными причинами, зависящими от природы контактирующих материалов. Главной причиной является обмен заряженными частицами, в результате которого создается избыток носителей электричества данного знака по одну сторону и их недостаток по другую сторону границы раздела. Обмен заряженными частицами приводит к возникновению двойного электрического слоя. Двойной электрический слой подобен заряженному конденсатору с определенной разностью потенциалов между обкладками.
 2018-01-21
2018-01-21 727
727








