рН + рОН = 14.
Зная одну из этих величин, легко определить другую.
| рН | Концентрация, моль/л | Среда | |
| ионов водорода | гидроксид-ионов | ||
| < 7 | > 10–7 | < 10–7 | Кислая |
| = 10–7 | =107 | Нейтральная | |
| > 7 | < 10–7 | > 10–7 | Щелочная |
Величина концентрации (активности) ионов водорода в растворе практически определяется, в основном, двумя методами – колориметрическим и потенциометрическим.
Определение рН-среды колориметрическим методом
Колориметрические методы определения реакции среды основаны на свойстве некоторых веществ изменять свою окраску в зависимости от активности ионов водорода в растворе. Такие вещества получили название кислотно - основных индикаторов: фенолфталеин, метилоранж и лакмус.
Изменение окраски наиболее распространенных индикаторов
В зависимости от реакции среды
| Индикатор | Окраска в среде | ||
| среда кислая | среда нейтральная | среда щелочная | |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метилоранж | красный | оранжевый | желтый |
| Лакмус | красный | фиолетовый | синий |
Таким образом, переход одной окраски, характерной для молекулярной формы кислотно-основного индикатора, в другую, свойственную его ионной форме, происходит под влиянием Н+ или ОН– ионов, то есть зависит от рН раствора.
Определение рН среды потенциометрическим методом выполняется с помощью специального прибора – потенциометра.
Вопрос №24 Гидролиз. Гидролиз солей. Количественные характеристики процесса гидролиза. Степень гидролиза и константа гидролиза. Смещение равновесия процесса гидролиза. Необратимый гидролиз. Напишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза следующих солей: FeCl3, K3PO4, Na2SО4, Al2S3. Укажите реакцию среды в водных растворах этих солей.
Гидролизом называется процесс взаимодействия вещества с водой, в результате которого нарушается ионное равновесие процесса диссоциации воды и меняется реакция среды.
Гидролизу подвергаются: соли, углеводы, белки, мыла, сложные эфиры, жиры, феноляты (щелочная среда), алкоголяты, галогенангидриды и другие вещества.
Гидролиз солей.
Гидролиз солей – это обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды и меняется реакция среды..
Возможность протекания гидролиза соли определяется наличием иона от слабого электролита.
Соли, образованные слабым основанием и слабой кислотой, гидролизуются практически полностью, а в других случаях гидролиз идет незначительно и преимущественно по первой ступени (один моль ион слабого электролита взаимодействует только с одним моль молекул воды).
Если соль образована анионом слабой кислоты ( S2–, 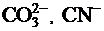 и др.) и катионом сильного основания, то происходит гидролиз по аниону, а среда будет щелочной.
и др.) и катионом сильного основания, то происходит гидролиз по аниону, а среда будет щелочной.
Если соль образована катионом слабого основания и анионом сильной кислоты, то происходит гидролиз по катиону, а среда становится кислотной.
 2018-01-21
2018-01-21 596
596








