1)Химические - составлены из разных электродов.
2)Концентрационные - составлены из одинаковых электродов с разными концентрациями электролита.
3)Термогальванические – составлены из одинаковых электродов, работающих при разных температурах.
Электродвижущая сила (ЭДС) гальванического элемента представляет собой разность потенциалов между катодом и анодом:
ЭДС = 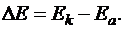 Например. Условная запись гальванического элемента, используемого для определения электродного потенциала меди, составленного из медного электрода и стандартного водородного электрода.
Например. Условная запись гальванического элемента, используемого для определения электродного потенциала меди, составленного из медного электрода и стандартного водородного электрода.
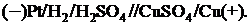
В состоянии равновесия (при отсутствии тока в цепи) на медном и водородном электродах имеют место следующие равновесия.
На водородном электроде:
2H+ + 2e– D H2,
на медном электроде:
Cu2+ + 2 e– D Cu0.
Учитывая, что катодом в любом гальваническом элементе является менее активный электрод (в рассматриваемом случае - медный) можем написать:
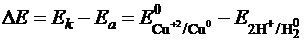
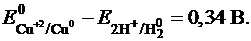
Медно-цинковый гальванический элемент
Cu | CuSO4 || ZnSO4 | Zn
цинк - отрицательный электрод, а медь - положительный. Нормальный потенциал цинка при 25° С равен -0,76 В. Нормальный потенциал меди при 25°С равен +0,34 В. ЭДС медно-цинкового гальванического элемента равна
(+0,337) - (-0,763) = + 1,10 (В), то есть:
Eo = ECu - EZn = Eo; (Cu2+/Cu) - Eo (Zn2+/Zn) = +0.337 - (-0.763) = +1.100 В.
Вопрос №32 Обратимые и необратимые электродные процессы. Обратимые и необратимые электроды. Типы обратимых электродов. Приведите примеры.
 2018-01-21
2018-01-21 795
795








