2Н2О + О2 + 4е- D 4ОН-
Б) в кислых средах -
О20 + 4Н+ D 2Н2О
Согласно теории электрохимической коррозии гетерогенность поверхности металла обусловлена пространственно разделенными катодными и анодными участками микроэлементов, вызванных лрисут --станем в металле примесей, структурных составляющих сплавов, деформированными или напряженными участками металла, окисной пленкой и ее дефектами и т.п. Участки поверхности металла, имеющие более отрицательный потенциал, являются анодами микроэлемента, более положительный потенциал - катодами.
Вопрос 35. Поляризация и деполяризация электродов. Как влияют эти процессы на коррозию металлов? В чем состоит сущность водородной и кислородной деполяризации?
Поляризация вызывается отставанием электродных процессов от процесса передвижения электронов в металле от анода к катоду. Анодная поляризация при коррозии металла может быть вызвана: перенапряжением ионизации металла, замедлением диффузии ионов металла от электрода в толщу раствора (концентрационная поляризация), пассивностью анода, т.е. особым состоянием металла, имеющим место при достижении определенного значения потенциала, называемого потенциалом пассивации, и связанного с образованием на поверхности анода защитных пленок. Катодная поляризация при коррозии металлов может быть вызвана: перенапряжением катодной реакции (присоединение электронов окислителем на катод происходит медленнее, чем образование электронов на аноде; электроны накапливаются у катода, сдвигая его потенциал в отрицательную сторону), замедленностью диффузии окислителя из объема электролита к катоду. Поляризация тормозит коррозионные процессы, и если бы этот процесс не имел бы места в реальных условиях, многие металлы потеряли бы свое техническое значение.
Любые процессы, уменьшающие явление поляризации, называются процессами деполяризации, а вещества ее вызывающие- деполяризаторами. Деполяризация ускоряет коррозионные процессы.
В зависимости от среды различают процессы коррозии, протекающие: а) с водородной деполяризацией, б) с кислородной деполяризацией. Наиболее распространена коррозия с кислородной деполяризацией, которая имеет место в нейтральных, щелочных и слабокислых средах. Примером коррозии с кислородной деполяризацией может служить коррозия углеродистой стали в атмосферных условиях. Катодный процесс коррозии с кислородной деполяризацией состоит из нескольких стадий: растворение кислорода воздуха в электролите, диффузия кислорода к катодным участкам коррелирующей поверхности, ионизация кислорода, диффузия ионов ОН- от катодных участков в раствор. Коррозия с водородной деполяризацией протекает в кислых средах и роль деполяризатора в этом случае выполняют ионы водорода Н+.
Вопрос 36. Электролиз с растворимыми и нерастворимыми электродами. Порядок разряда ионов на электродах при электролизе. Законы Фарадея. Практическое применение процессов электролиза.
Электролизом называется совокупность процессов, сопровождающих прохождение электрического тока через растворы или расплавы электролитов. Из растворов солей химически активные Ме, стоящие в ряду стандартных потенциалов до аллюминия включительно, на электроде не восстанавливаются, а восстанавливаются ионы водорода. На катоде легче всего восстанавливаются ионы менее активных Ме, стоящих в РСП после водорода. Из растворов солей Ме, которые расположены между аллюминием и водородом, восстанавливаются, но и возможно восстановление ионов водорода. Процессы, протекающие при электролизе обратны процессам, идущим при работе гальвонического элемента: при электролизе химическоя реакция осуществляется за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нём химической реакции превращается в электрическую энергию. Таким образом при электролизе возникает ГЭ (зарядка). При рассмотрении анодных процессов следует иметь в виду, что на аноде может идти процесс окисления материала самого электрода. В связи с этим различают электролиз с растворимым и нерастворимым анодом. Нерастворимым называется анод, материал которого не претерпевает окисления в ходе электролиза. Растворимым называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для первого случая чаще всего применяют графит, уголь, платину. На нерастворимом аноде при электролизе водных растворов щелочей и фторидов происходит электрохимическое окисление воды с выделением кислорода. При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы (отрицательно заряженные ионы). Эта аномалия связана со значительным перенапряжением второго из этих процессов - материал анода оказывает тормозящее действие на процесс выделения кислорода.В случае растворимого анода число конкурирующих окислительных процессов возрастает до трёх: электрохимическое окисление воды с выделением кислорода, разряд аниона и электрохимическое окисление металла анода. Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в РСП раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона. З-Ны Фарадея: 1.Масса вещества, выделяющегося на электроде при электролизе, пропорциональна количеству прошедшего через раствор электричества. 2. Массы окисляющихся и восстанавливающихся на электродах веществ, при пропускании через раствор одного и того же количества электричества, пропорциональны молярным массам их эквивалентов. Практическое применение электролиза. Электрохимические процессы широко применяются в различных областях современной техники, в аналитической химии, биохимии и т. д. В химической промышленности электролизом получают хлор и фтор, щелочи, хлораты, надсерную кислоту, химически чистые водород и кислород и т. д. При этом одни вещества получают путем восстановления на катоде (альдегиды, парааминофенол и др.), другие электроокислением на аноде (хлораты, перхлораты, перманганат калия и др.). Электролиз в гидрометаллургии является одной из стадий переработки металлсодержащего сырья, обеспечивающей получение товарных металлов. Электролиз может осуществляться с растворимыми анодами - процесс электрорафинирования или с нерастворимыми - процесс электроэкстракции. Главной задачей при электрорафинировании металлов является обеспечения необходимой чистоты катодного металла при приемлемых энергетических расходах.
Вопрос 37. Способы защиты металлов от коррозии. Металлические катодные и анодные покрытия. Рассмотрите на каком-либо примере механизм защитного действие анодного металлического покрытия в кислой среде.
Коррозией металлов (лат. сorrosio - разъедание) называется самопроизвольный процесс разрушения металлов под действием окружающей среды. В зависимости от используемого материала, назначения, условий эксплуатации, требований по надежности, технических возможностей и экономичности в настоящее время применяют различные методы борьба с коррозией. Важнейшие среди них: Рациональное конструирование. Выбор коррозионно-стойких материалов. Применение защитных покрытий. Обработка коррозионно агрессивной среды. Электрохимическая защита
Металлические покрытия используются для защиты легкокорродирующего металла тонким сплошным слоем другого металла или сплава, более стойкого в данных условиях эксплуатации, а также в целях повышения твердости, электропроводности, придания им красивого внешнего вида. С этой целью используют хром, никель, цинк, олово, алюминий, кадмий.
По характеру защитного действия металлические покрытия подразделяются на катодные и анодные.
Катодные металлические покрытия - это покрытия, при которых покрывающий металл имеет более положительный электродный потенциал, чем металл защищаемого изделия, например, сталь,покрытая оловом или медью.
Анодные металлические покрытия - это покрытия менее активного металла более активным, то есть имеющим меньшую величину электродного потенциала в данной среде.

Анодное покрытие, например цинк на железе рис.11.5.б при нарушении его целостности будет само подвергаться коррозии и, разрушаясь, будет защищать основной металл. В этом случае на железе протекает катодный процесс восстановления водорода, который не приводит к разрушению железа.
Вопрос 38. Способы защиты металлов от коррозии. Металлические катодные и анодные покрытия. Как протекает коррозия металла с катодным металлическим покрытием при нарушении его целостности в водной среде в присутствии кислорода?
Коррозией металлов (лат. сorrosio - разъедание) называется самопроизвольный процесс разрушения металлов под действием окружающей среды. В зависимости от используемого материала, назначения, условий эксплуатации, требований по надежности, технических возможностей и экономичности в настоящее время применяют различные методы борьба с коррозией. Важнейшие среди них: Рациональное конструирование. Выбор коррозионно-стойких материалов. Применение защитных покрытий. Обработка коррозионно агрессивной среды. Электрохимическая защита. "Коррозионностойкие покрытия. По механизму защиты различают анодные и катодные металлические покрытия. Металл анодных покрытий имеет электродный потенциал более отрицательный, чем потенциал защищаемого металла. В случае применения анодных покрытий не обязательно, чтобы оно было сплошным. При действии растворов электролитов в возникающим коррозионном элементе основной металл–покрытие основной металл является катодом и поэтому при достаточно большой площади покрытия не разрушается, а защищается электрохимически за счёт растворения металла покрытия. Примерами анодных покрытий являются покрытия железа цинком и кадмием. Анодные покрытия на железе, как правило, обладают сравнительно низкой стойкостью.
Катодные металлические покрытия, электродный потенциал которых более электроположителен, чем потенциал основного металла, могут служить надёжной защитой от коррозии только при условии отсутствия в них сквозных пор, трещин и других дефектов, так как они механически препятствуют проникновению агрессивной среды к основному металлу. Примерами катодных защитных покрытий являются покрытия железа медью, никелем, хромом и т.п.
Вопрос 39. Способы защиты металлов от коррозии. Неметаллические защитные покрытия. Виды неметаллических защитных покрытий и их применение.
Коррозией металлов (лат. сorrosio - разъедание) называется самопроизвольный процесс разрушения металлов под действием окружающей среды. В зависимости от используемого материала, назначения, условий эксплуатации, требований по надежности, технических возможностей и экономичности в настоящее время применяют различные методы борьба с коррозией. Важнейшие среди них: Рациональное конструирование. Выбор коррозионно-стойких материалов. Применение защитных покрытий. Обработка коррозионно агрессивной среды. Электрохимическая защита.
Неметаллические защитные покрытия применяются для изоляции металлических изделий, их защиты от воздействия внешней среды (влаги), придания красивого вида.
Среди неметаллических защитных покрытий следует отметить: лаки, краски, эмали, пластичные смазки, полимерные материалы, резины и каучуки, битумы, утлеграфитовые материалы, цементы.
Неметаллические защитные покрытия принято разделять на лакокрасочные, полимерные, покрытия резинами, смазками, силикатными эмалями, пастами.
Лакокрасочные защитные покрытия широко распространены и применяются наиболее часто. В состав покрытия входят пленкообразующие вещества, наполнители, пигменты, пластификаторы, растворители, катализаторы. Покрытие такого рода не только хорошо защищает изделие в различных атмосферах, но и придают ему приятный внешний вид.
Полимерные защитные покрытия наносятся на поверхность изделия в виде горячей смолы с целью защиты его от внешней среды.
Защитное покрытие резинами (гуммирование) осуществляется резиной и эбонитом для защиты от воздействия внешней среды различных емкостей, трубопроводов, цистерн, химических аппаратов, резервуаров для перевозки и хранения химических веществ.
Вопрос 40. Способы защиты металлов от коррозии. Химическая обработка среды. Регулирование pH, удаление кислорода.
Коррозией металлов (лат. сorrosio - разъедание) называется самопроизвольный процесс разрушения металлов под действием окружающей среды. В зависимости от используемого материала, назначения, условий эксплуатации, требований по надежности, технических возможностей и экономичности в настоящее время применяют различные методы борьба с коррозией. Важнейшие среди них: Рациональное конструирование. Выбор коррозионно-стойких материалов. Применение защитных покрытий. Обработка коррозионно агрессивной среды. Электрохимическая защита. Химические защитные покрытия создаются путем химической обработки поверхности металла. Наиболее часто используется оксидирование - создание на поверхности металла слоя оксида, что достигается химическим или электрохимическим путем. Химическая обработка среды с целью снижения ее коррозионной агрессивности направлена на снижение концентрации веществ, вызывающих или ускоряющих коррозионный процесс, а также связана с применением специальных веществ - ингибиторов коррозии, добавление которых в ничтожно малых количествах (десятые доли.
При электрохимической коррозии обработка коррозионной среды сводится и удалению деполяризаторов O2 и Н+.
Удаление кислорода из водной среды может быть обеспечено пропусканием ее через фильтры, наполненные металлической стружкой, связывающей растворенный кислород, а также обработкой некоторыми реагентами:
а) сульфитами
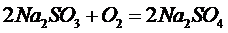 ;
;
б) гидразином
 .
.
Снижение концентрации ионов водорода достигается нейтрализацией среды щелочами, содой, известью.
Раствор соды (карбоната натрия) используется для регулирования рН среды, так как в водных растворах протекает гидролиз этого вещества и среда приобретает явно выраженный щелочной характер:
Na2CO3 + H2O D NaHCO3 + H2O pH > 7
процента) приводит к существенному уменьшению скорости коррозии.
 2018-01-21
2018-01-21 631
631








