1. Укажите число неспаренных электронов в основном состоянии атома хрома:
а) 5; б) 6; в) 4; г) 3.
2. В атоме какого элемента в основном состоянии на 4-ом энергетическом уровне содержится 5 электронов:
а) германия; б) мышьяка; в) ванадия; г) хрома.
3. Укажите формулу высшего гидроксида элемента с сокращенной электронной конфигурацией … 3s23p4:
а) Э(ОН)2; б) НЭО4; в) Н2ЭО4; г) Э(ОН)3
4. При небольшом увеличении давления растворимость газов в воде:
а) возрастает; б) уменьшается;
в) не изменяется; г) сначала возрастает, затем уменьшается
5. Какова массовая доля (С%) гидроксида натрия в растворе, содержащем в 50 мл 25 г NaOH: а) 31,3; б) 32,3; в) 33,3; г) 34,3
6. Определите, в каком направлении будет протекать реакция при Т = 1290 К:
NH4CI(к) = NH3(г)+НС1(г), Δ S =11,2 кДж/(моль -К), ΔН = 290 кДж/моль.
а) вправо; б) химическое равновесие; в) влево; г) не изменится
7. Чему равна молярная концентрация раствора серной кислоты, в одном литре которого содержится 196 г H2SO4?
а) 2 моль/л; б) 4 моль/л; в) 1 моль/л; г) 6 моль/л
8. Любая окислительно-восстановительная реакция включает в себя два процесса:
а) гидролиз и диссоциацию; б) ионизацию и диссоциацию;
в) окисление и восстановление; г) выделение и поглощение теплоты
9. Какие процессы являются окислительно-восстановительными:
а) синтез аммиака: H2 + N2 ® NH3
б) гашение извести: CaO + H2O ® Ca(OH)2
в) обжиг пирита: FeS2 + O2 ® Fe2O3 + SO2
г) гидролиз хлорида железа (III): FeCl3 + H2O ® Fe(OH)Cl2 + HCl
10. Какое из соединений может проявлять только восстановительные свойства:
а) H2SO3; б) H2S; в) H2SO4; г) SO2
11. Найдите объем кислорода (нормальные условия), который выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор КОН:
а)627 мл; б) 1,25 л; в) 1,79 л; г) 2,5л
12. Какой из металлов лучше защитит железо? Какое это будет покрытие:
а) медь; катодное; б) медь; анодное;
в) хром; катодное; г) хром; анодное
13. Какой процесс протекает на катоде при работе железоникелевого гальванического элемента? Активности (концентрации) потенциалопределяющих ионов в электролитах равны 1 моль/л:
а) Fe2+ + 2e- ® Fe0 б) Ni0 ® Ni2+ + 2e-
в) Fe0 ® Fe2+ + 2e- г) Ni2+ + 2e- ® Ni0
14. Как изменится прочность связи в водородных соединениях элементов V группы главной подгруппы с увеличением заряда ядра атома:
а) растет; б) уменьшается;
в) не изменяется; г) сначала растет, затем уменьшается
Примеры решения типовых задач.
Модуль №1.
Пример 1. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 см3 кислорода (н.у.)?
Решение. Так как мольная (молярная) масса О2 (32 г/моль) при н.у. занимает объем 22,4 л, то объем эквивалентной массы кислорода (8 г/моль) будет 22,4: 4 = 5,6 л = 5600 см3. По закону эквивалентов


 mМе V (О2) mМе 310
mМе V (О2) mМе 310
 mэ(Ме) = Vmэ (О2) или 12,16 = 5600
mэ(Ме) = Vmэ (О2) или 12,16 = 5600
откуда mМе = 12,16 . 310: 5600 = 0,673 г.
Пример 2. Вычислите эквиваленты и эквивалентные массы H2SO4 и Al(OH)3 в реакциях, выраженных уравнениями:
H2SO4 + KOH = KHSO4 + H2O (1)
H2SO4 + Mg = MgSO4 + H2 (2)
Al(OH)3 + HCl = Al(OH)2Cl + H2O (3)
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O (4)
Решение. Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. Эквивалентная масса кислоты (основная) равна мольной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп). Следовательно, эквивалентная масса H2SO4 в реакции (1) МH2SO4 = 98 г/моль, а в реакции (2) МH2SO4 /2 = 49 г/моль. Эквивалентная масса Al(OH)3 в реакции (3) МAl(OH)3 = 78 г/моль, а в реакции (4) МAl(OH)3/3 = 26 г/моль.
Задачу можно решить и другим способом. Так как H2SO4 взаимодействует с одной эквивалентной массой KOH и двумя эквивалентными массами магния, то ее эквивалентная масса равна в реакции (1) М/1 г/моль и в реакции (2) М/2 г/моль. Al(OH)3 взаимодействует с одной эквивалентной массой HCl и тремя эквивалентными массами HNO3, поэтому его эквивалентная масса в реакции (3) равна М/1 г/моль, в реакции (4) М/3 г/моль.
Эквиваленты H2SO4 в уравнениях (1) и (2) соответственно равны 1 моль и ½ моль; эквиваленты Al(OH)3 в уравнениях (3) и (4) соответственно равны 1 моль и 1/3 моль.
Пример 3. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (mэ(Ме)).
Решение. При решении задачи следует иметь в виду: а) эквивалент (эквивалентная масса) гидроксида равен сумме эквивалентов (эквивалентных масс) металла и гидроксильной группы; б) эквивалент (эквивалентная масса) соли равен сумме эквивалентов (эквивалентных масс) металла и кислотного остатка. Вообще эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
Учитывая это, подставляем соответствующие данные в уравнение:
m1 m2 3,85 mэ(Ме) + mэ(NO3-)



 mэ(1) = mэ(2) получим 1,60 = mэ(Ме) mэ(OH-)
mэ(1) = mэ(2) получим 1,60 = mэ(Ме) mэ(OH-)
3,85 mэ(Ме) + 62

 1,60 = mэ(Ме) + 17; mэ(Ме) = 15 г/моль
1,60 = mэ(Ме) + 17; mэ(Ме) = 15 г/моль
Пример 4. Какую высшую и низшую степень окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение. Высшую степень окисления элемента определяет номер группы периодической системы Д.И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2; np6).
Данные элементы находятся соответственно VA, VIA, VIIA – группах и имеют структуру внешнего энергетического уровня s2p ; s2p4 и s2p5. Ответ на вопрос смотри в таблице 1.
Таблица 1. Степени окисления мышьяка, селена, брома.
| Элемент | Степень окисления | Соединения | |
| высшая | низшая | ||
| As | + 5 | - 3 | H3AsO4; H3As |
| Se | + 6 | - 2 | SeO3; Na2Se |
| Br | + 7 | - 1 | KBrO4; KBr |
Пример 5. У какого из элементов четвертого периода – марганца или брома – сильнее выражены металлические свойства?
Решение. Электронные формулы данных элементов
25 Mn 1s2 2s2 2p6 3s2 3p6 3d5 4s2
35 Br 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
Марганец – d – элемент VIIВ – группы, а бром – р – элемент VIIА – группы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а, следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают определенным сродством к электрону, а, следовательно, приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р – и d – элементы, является преобладание металлических свойств у d – элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Модуль №2.
Пример 1. Определите стандартную теплоту сгорания 1 моля метана, исходя из стандартных энтальпий образования этого вещества и продуктов его сгорания.
Решение. Запишем уравнение реакции сгорания метана:

Согласно следствию из закона Гесса, тепловой эффект этой реакции будет равен разности энтальпий образования продуктов реакции и исходных веществ:
 = 1 моль ·
= 1 моль ·  + 2 моль·
+ 2 моль·  - 1 моль·
- 1 моль· 
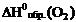 = 0 кДж/моль (как и для других простых веществ устойчивых при стандартных условиях).
= 0 кДж/моль (как и для других простых веществ устойчивых при стандартных условиях).
Находим стандартные энтальпии образования в таблицах:
 = -393,5 кДж/моль = -393,5 кДж/моль
|  = - 241,8 кДж/моль = - 241,8 кДж/моль
|
 = - 74.9 кДж/моль = - 74.9 кДж/моль
|
Подставим найденные величины в уравнение:
 =1 моль·(-393,5 кДж/моль) – 2 моль·(-241,8)·кДж/моль + 1 моль ·74,9 кДж/моль = -802,2кДж
=1 моль·(-393,5 кДж/моль) – 2 моль·(-241,8)·кДж/моль + 1 моль ·74,9 кДж/моль = -802,2кДж
Поскольку тепловой эффект реакции вычислялся для сгорания 1 моля метана, то стандартная теплота сгорания метана равна = -802,2кДж/моль
Пример 2. Определите, как изменяется скорость реакции 2СО + О2 = 2СО2 если общее давление в системе уменьшить в 2 раза.
Решение. Согласно закону действия масс скорость реакции равна:
v1 = k[с(CO)]2с(O2)
Уменьшение давления в системе в два раза равноценно уменьшению вдвое концентрации реагирующих веществ. Поэтому после уменьшения давления скорость реакции составит:
v2 = k[0,5·с(CO)]2[0,5·с(O2)] = 0,25·0,5· k[с(CO)]2с(O2) = 0,125· v1
v2/ v1 = 0,125· v1/ v1 = 1/8
Таким образом, после уменьшения давления в 2 раза скорость реакции уменьшится в 8 раз.
Пример 3. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 500С?
Решение. Согласно правилу Вант-Гоффа:
 ,
,
где:
v1 – скорость реакции при температуре t1 (в нашем случае 20 0 С);
v2 – скорость реакции при температуре t2 (в нашем случае 50 0 С);
γ – температурный коэффициент скорости реакции (в нашем случае 2,8).
Подставляя заданные значения величин в уравнение, получим:
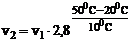 , отсюда:
, отсюда: 
Прологарифмируем обе части уравнения (воспользовавшись, например, программой «Инженерный калькулятор» «Windows»):
 , отсюда:
, отсюда: 
Таким образом, скорость реакции увеличится в 21,9 раза.
Модуль №3.
Пример 1. Найти массу воды и массу 20%-ного раствора сульфата меди (CuSO4) с массовой долей растворенного вещества 20%, необходимых для приготовления 1 л раствора с массовой долей сульфата меди 8%. Плотность 8% раствора CuSO4 равна 1,084 г/мл.
Решение. Найдем массу содержащегося в конечном растворе сульфата меди. Для этого запишем формулу для вычисления массовой доли растворенного вещества. Преобразуем эту формулу, выразив массу конечного раствора через произведение его объема на плотность. В полученное выражение подставим значения приведенных в условии величин:
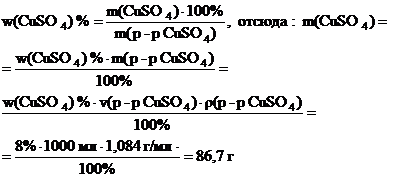
Поскольку сульфат меди приходит в конечный раствор из исходного раствора с массовой долей соли 20%, то для этого раствора справедливо следующее выражение:

Масса воды, необходимой для приготовления конечного раствора, найдется путем вычитания из массы конечного раствора массы 20%-ного раствора сульфата меди:
1,084 г/мл ∙ 1000 мл – 433,5 г = 650,5 г
Таким образом, для приготовления искомого раствора нужно взять 433,5 г 20%-ного раствора сульфата меди и 650,5 г воды.
Пример 2. Смешали 15 мл 10%-ного раствора (ρ = 1,015 г/см3) азотной кислоты и 150 мл 30%-ного раствора (ρ= 1,15 г/см3) азотной кислоты. Чему равна процентная концентрация С% полученного раствора?
Решение:
а) Найдем массу 1-го раствора: m1 = ρ . V = 1,015 . 15=15,225 г, который содержит m (HNO3) = 10 / 100 . 15,225 = 1,52 г
б) Найдем массу 2-го раствора: m1 = ρ . V = 1,15 . 150 = 172,5 г, который содержит m (HNO3) = 30 / 100 . 172,5 = 51,75 г
в) Находим С%: 1,52 + 51,75
 С% = • 100% = 28,38 %
С% = • 100% = 28,38 %
15,22 + 172,5
Пример 3. Чему равна концентрация гидроксид–ионов в растворе, рН которого равен 10?
Решение. Из ионного произведения воды: [H+]·[OH-] = 10-14 выразим концентрацию гидроксид-ионов: [OH-] = 10-14 / [H+]
Поскольку pH = -lg [H+] = 10, то [H+] = 10-10
Подставив это значение в предыдущее уравнение получим:
[OH-] = 10-14 / 10-10 = 10-4 (моль/л)
Таким образом, концентрация гидроксид-ионов в этом растворе составляет 10-4 моль/л
Пример 4. Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) HCl и NaOH; б) Pb(NO3)3 и Na2S; в) NaClO и HNO3; г) K2CO3 и H2SO4; д) CH3COOH и NaOH.
Решение: Запишем уравнения взаимодействия указанных веществ в молекулярном виде:
а) HCl + NaOH = NaCl + Н2О б) Pb(NO3)3 + Na2S = PbS + 2NaNO3
в) NaClO + HNO3 = NaNO3 + НClO г) K2CO3 + H2SO4 = K2SO4 + СО2 + Н2О
д) CH3COOH + NaOH = CH3COONa + Н2О
Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием слабых электролитов (Н2О, НClO), осадка (PbS), газа (СО2).
В реакции (д) два слабых электролита, но так как реакции идут в сторону большего связывания ионов и вода – более слабый электролит, чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства, получим ионно-молекулярные уравнения соответствующих реакций:
а) H+ + OH- = Н2О б) Pb2+ + S2- = PbS
в) ClO- + H+ = НClO г) CO32- + 2H+ = СО2 + Н2О
д) CH3COOH + OH- = CH3COO- + Н2О
Модуль №4.
Пример 1. Реакция выражается схемой: P + HNO3 + H2O→H3PO4 + NO
Составить электронные уравнения. На основании электронных уравнений расставить коэффициенты в уравнении реакции.
Решение. Устанавливаем, у каких атомов изменилась степень окисления в результате реакции. Значение степени окисления пишем над соответствующими символами элементов:
P0 + HN5+O3 + H2O→H3P5+O4 + N2+O
Составляем электронные уравнения. На основе электронных уравнений определяем коэффициенты для окислителя, восстановителя, продуктов окисления и восстановления. Для этого находим наименьшее кратное от числа электронов, отданных восстановителем и принятых окислителем, и множители к ним, которые и являются коэффициентами. Множители принято ставит слева от электронных уравнений за вертикальной чертой:
Восстановитель 3 P0-5ē = P5+ процесс окисления
Окислитель 5 N 5++ 3ē = N2+ процесс восстановления
Расставляем найденные коэффициенты: 3P + 5HNO3 + 2H2O→3H3PO4 + 5NO
Пример 2. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: а) H2S и HI; б) H2S и H2SO3; в) H2SO3 и HClO4?
Решение. а) Степень окисления в H2S n (S) = -2; в HI n (I) = -1. Так как и сера, и йод находятся в своей низшей степени окисления, то оба взятые вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в H2S n (S) = -2 (низшая); в H2SO3 n (S) = +4 (промежуточная). Следовательно, взаимодействие этих веществ возможно, причем H2SO3 является окислителем; в) в H2SO3 n (S) = +4 (промежуточная); в HclO4 n (Cl) = +7 (высшая). Взятые вещества могут взаимодействовать. H2SO3 в этом случае будет проявлять восстановительные свойства.
Модуль №6.
Пример 1. Сколько времени потребуется для полного разложения в электролизере 2 молей воды электрическим током силой 2 А?
Решение. В электролизере на аноде и катоде происходят следующие процессы:
А: 2H2O – 4ē → 4H+ + O2↑
К: 4H2O + 4ē → 4OH- + 2H2↑
2H2O→2H2↑- + O2↑
В соответствии с законами Фарадея:  ,
,
где m–масса вещества B, претерпевшая электрохимическое превращение, г; Мэкв. – молярная масса электрохимических эквивалентов вещества B, г/моль экв.; F – число Фарадея, F=96500 Кл/моль экв.; I – ток, А.
Выразим из этой формулы время:

Для вычисления молярной массы электрохимических эквивалентов воды учтем, что ее разложение протекает и на аноде, и на катоде. Как это следует из суммарного уравнения реакций, при прохождении через электролизер 4 моль электронов на аноде и катоде суммарно разлагается 2 моль воды, отсюда:

Масса 2 моль воды: m(H2O) = 2 моль ∙ 18 г/моль = 36 г
Отсюда:
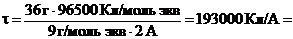 193000 с (или 53,6 ч).
193000 с (или 53,6 ч).
Пример 2. Стальная деталь покрыта слоем хрома. Какие коррозионные процессы будут происходить, если покрытие будет механически нарушено (например, вследствие царапины)? Приведите схему образующихся при этом гальванических элементов и рассчитайте их ЭДС для случаев кислой и нейтральной сред.
Решение. При проявлении царапины на покрытии возникает гальванический элемент: железо – хром. Катодом (электродом, на котором происходит процесс восстановления) станет электрод с большим стандартным электродным потенциалом. Находим значения стандартных электродных потенциалов в таблице:
 - 0,440 В;
- 0,440 В; 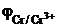 = - 0,744 В.
= - 0,744 В.
Большее значение имеет стандартный электродный потенциал железа. Следовательно, катодом будет железо, а анодом, т.е. электродом на котором происходит процесс окисления, хром. А: Cr – 3 ē → Cr3+
Теперь необходимо выяснить какие частицы восстанавливаются на катоде. В зависимости от среды это либо ионы водорода (кислая среда), либо кислород (нейтральная среда). Источником этих веществ является атмосфера.
K: 2H+ + 2 ē → H2 (кислая среда),  0 В
0 В
K: O2 +2H2O + 4 ē → 4OH- (нейтральная среда), 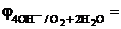 + 0,401 В
+ 0,401 В
Таким образом, в кислой среде возникнет следующий коррозионный гальванический элемент, в котором будет окисляться хром (анод), а восстанавливаться ионы водорода (катод):
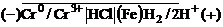 , ЭДС которого в стандартных условиях:
, ЭДС которого в стандартных условиях:
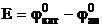 = 0 – (- 0,744 В) = 0,744 В.
= 0 – (- 0,744 В) = 0,744 В.
В нейтральной среде возникнет коррозионный гальванический элемент, в котором будет окисляться хром (анод), а восстанавливаться кислород (катод):

ЭДС этого элемента:
 = +0,401-(-0,744) = 1,145 В.
= +0,401-(-0,744) = 1,145 В.
Модуль №7.
Пример 1. Написать уравнения реакций последовательного замещения в молекуле метана всех четырех атомов водорода хлором.
Решение, а) СН4 + Сl2 ® СН3Сl + НС1
б) СН3Сl + Сl2 ® СН2Сl2 + НСl
в) СН2Сl2 + Сl2 ® СНСl3 + НСl
г) СНСl3 + Сl2 ® ССl4 + НСl
Пример 2. Чем отличается по свойствам фенол от спиртов?
Решение. Фенол обладает всеми свойствами, характерными для спиртов, но в отличие от последних он обладает слабыми кислотными свойствами и поэтому может взаимодействовать со щелочами:
С6Н5ОН + NaOH → C6H5ONa + Н2О
Контрольные вопросы для подготовки к зачету и экзамену.
1. Основные понятия химии. Вещество, материя, атом, химический элемент, моль. Атомная, молекулярная и молярная массы. Атомная единица массы. Абсолютная и относительная атомные и молекулярные массы.
2. Качественный и количественный состав вещества. Молярный объем. Число Авогадро.
3. Важнейшие стехиометрические законы. Закон сохранения массы вещества, закон постоянства состава, закон простых объёмных отношений, закон Авогадро и следствия из этого закона. Относительная плотность газов.
4. Эквивалент и молярная масса эквивалента (эквивалентная масса) простых и сложных веществ. Молярный объем эквивалента (эквивалентный объем). Закон эквивалентов.
5. Понятие о квантовых числах. Главное, орбитальное, магнитное и спиновое квантовые числа. Пределы их изменения. Нормальное и возбужденное состояние атома.
6. Строение электронных оболочек атомов. Принцип наименьшей энергии, правило Гунда, принцип Паули. Электронная структура атомов и периодическая система Д.И. Менделеева. Формулировка периодического закона Д.И. Менделеева. Напишите электронные и электронно-графические формулы атомов с порядковыми номерами 13, 22, 29, 50,74.
7. Химическая связь. Виды химической связи: ковалентная, ионная и металлическая. Полярная и неполярная ковалентная связь. Два механизма образования ковалентной связи (обычный и донорно-акцепторный). Понятие о дипольном моменте молекул. Укажите типы связей в молекулах: CI2, HCI, KBr, KHSO4?
8. Энергия ионизации, энергия сродства к электрону. Электроотрицательность. Относительная электроотрицательность. Характер изменения ее величины в рядах и периодах периодической системы Д.М. Менделеева. Степень окисления. Определите степень окисления всех атомов в молекулах: HNO3, CaH2, KMnO4, (NH4) 2Cr2O7.
9. Химическая термодинамика. Понятия о внутренней энергии, энтропии, энтальпии, изобарно-изотермическом потенциале. Расчет теплового эффекта химической реакции. Термодинамические условия возможности протекания химических реакций.
10. Химическая кинетика. Скорость химических реакций. Зависимость скорости реакций от концентрации реагирующих веществ и давления. Закон действующих масс. Константа скорости химической реакции. Во сколько раз увеличиться скорость реакции: N2+3H2 → 2NH3 при увеличении давления в 2 раза?
11. Химическая кинетика. Скорость химических реакций. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Энергия активации. Как изменится скорость реакции, имеющей температурный коэффициент g=3, при повышении температуры с 20 до 60 0С?
12. Химическая кинетика. Факторы, влияющие на скорость химических реакций. Катализаторы. Зависимость скорости химических реакций от катализатора. Положительный и отрицательный катализ. Какое влияние оказывает катализатор на состояние химического равновесия?
13. Химическое равновесие. Константа химического равновесия. Влияние концентрации, температуры и давления на состояние равновесия. Принцип Ле-Шателье. Как следует изменить условия для того, чтобы равновесие реакции: COCI2 → CO+CI2 DH> 0 сместить вправо?
14. Растворы. Классификация растворов по степени дисперсности. Место растворов среди других дисперсных систем. Растворимость твердых веществ в воде. Коэффициент растворимости. Насыщенные, ненасыщенные и пересыщенные растворы.
15. Растворы. Способы количественного выражения состава растворов. Массовая, объемная и мольная доли. Массовая, молярная и нормальная концентрации. Моляльность. Переход от одного способа количественного выражения состава раствора к другому. Найти массовую, молярную и нормальную концентрации раствора хлорида кальция c массовой долей 20%. Плотность раствора 1,2 г/см3.
16. Растворы неэлектролитов. Закон Рауля. Как можно рассчитать повышение температуры кипения и понижение температуры замерзания раствора по сравнению с растворителем?
17. Электролитическая диссоциация. Диссоциация слабых электролитов как равновесный процесс. Степень диссоциации и константа диссоциации. Факторы, влияющие на процесс диссоциации. Закон разбавления Оствальда. Как будет влиять на состояние равновесия уксусной кислоты введение в систему ацетата натрия?
18. Растворы электролитов. Диссоциация средних, кислых и основных солей. Диссоциация кислот и оснований. Ступенчатая диссоциация. Приведите примеры.
19. Реакции ионного обмена в растворах электролитов. Условия практической необратимости протекания реакций ионного обмена. Напишите молекулярные и ионно-молекулярные уравнения реакций, иллюстрирующих эти условия.
20. Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Шкала водородного показателя. Индикаторы. Изменение окраски индикаторов в зависимости от реакции среды.
21. Гидролиз. Гидролиз солей. Количественные характеристики процесса гидролиза. Степень гидролиза и константа гидролиза. Смещение равновесия процесса гидролиза. Необратимый гидролиз. Напишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза следующих солей: FeCl3, K3PO4, Na2SО4, Al2S3. Укажите реакцию среды в водных растворах этих солей.
22. Классификация элементов по химической природе. Химические свойства элементарных веществ. Общий обзор простых соединений элементов и характер химической связи в них.
23. Различные типы лигандов и комплексных соединений. Соединение комплексных анионов. Соединения комплексных катионов и нейтральные комплексы.
24. Окислительно-восстановительные реакции. Степень окисления элемента. Окислитель и восстановитель. Процессы окисления и восстановления. Приведите примеры типичных окислителей и восстановителей. Какие процессы представляют собой процессы окисления, а какие восстановления:
S-2 → S0 Cr2O72- → Cr+3 Mg0 → Mg+2 O2 +2H2O → 4OH-
25. Классификация окислительно-восстановительных реакций. Приведите примеры реакций каждого типа. Составьте уравнения соответствующих реакций с помощью метода электронного баланса.
26. Характер взаимодействия металлов с водой, растворами солей, щелочей и кислот. Особенности взаимодействия металлов с концентрированной серной кислотой и азотной кислотой. Как реагирует железо с сильно разбавленной, разбавленной и концентрированной азотной кислотой? Составьте уравнения соответствующих реакций.
27. Возникновение скачка потенциала на границе металл - раствор соли металла. Стандартный электродный потенциал. Ряд стандартных электронных потенциалов металлов. Какие выводы можно сделать исходя из положения металла в ряду?
28. Водородный электрод. Устройство и электродные процессы. Стандартный водородный электрод. Зависимость величины потенциала водородного электрода от рН среды.
29. Гальванические элементы. Как можно практически определить электродный потенциал металла? От каких факторов зависит величина электродных потенциалов? Уравнение Нернста. Уравнение Нернста для металлических электродов при стандартных условиях.
30. Типы гальванических элементов. Химические, концентрационные и термогальванические элементы. Э.Д.С. гальванических элементов. Приведите примеры. Укажите процессы, протекающие на электродах, и рассчитайте ЭДС медно-цинкового химического гальванического элемента.
31. Обратимые и необратимые электродные процессы. Обратимые и необратимые электроды. Типы обратимых электродов. Приведите примеры.
32. Коррозия металлов. Классификация коррозионных процессов. Химическая и электрохимическая коррозия. Приведите примеры. Микро - и макрогальванические элементы. Причины электрохимической гетерогенности поверхности металла. Какие процессы протекают при коррозии цинка с примесями железа в кислой среде?
33. Электродные процессы при коррозии металлов. Катодные реакции в кислых, нейтральных и щелочных средах. Чем может быть вызвана электрохимическая гетерогенность поверхности металла?
34. Поляризация и деполяризация электродов. Как влияют эти процессы на коррозию металлов? В чем состоит сущность водородной и кислородной деполяризации?
35. Электролиз с растворимыми и нерастворимыми электродами. Порядок разряда ионов на электродах при электролизе. Законы Фарадея. Практическое применение процессов электролиза.
36. Способы защиты металлов от коррозии. Металлические катодные и анодные покрытия. Рассмотрите на каком-либо примере механизм защитного действие анодного металлического покрытия в кислой среде.
37. Способы защиты металлов от коррозии. Металлические катодные и анодные покрытия. Как протекает коррозия металла с катодным металлическим покрытием при нарушении его целостности в водной среде в присутствии кислорода?
38. Способы защиты металлов от коррозии. Неметаллические защитные покрытия. Виды неметаллических защитных покрытий и их применение.
39. Способы защиты металлов от коррозии. Химическая обработка среды. Регулирование pH, удаление кислорода.
40. Способы защиты металлов от коррозии. Электрохимическая защита. Протекторная защита и катодная защита.
41. Металлы. Положение металлов в периодической системе. Металлическая связь. Восстановительные свойства металлов. Энергия ионизации и электродный потенциал.
42. Семейства s-, p-, d-элементов. Положение в периодической системе. Строение их атомов. Степени окисления. Свойства оксидов и гидроксидов. Окислительно-восстановительные свойства простых тел и соединений элементов каждого семейства.
43. Особенности органических соединений. Теория химического строения. Изомерия и гомология. Классификация и номенклатура органических соединений.
44. Углеводороды: алканы, алкены, алкины, алкадиены, ароматические соединения.
45. Производные углеводородов: галогенпроизводные, спирты, альдегиды и кетоны, фенолы, простые эфиры, карбоновые кислоты, сложные эфиры, нитросоединения, амины.
46. Мономеры, олигомеры и полимеры. Методы получения полимеров. Реакции полимеризации и поликонденсации. Строение и свойства полимеров.
47. Химическая идентификация как цель качественного анализа. Идентификация катионов неорганических веществ.
48. Химическая идентификация как цель качественного анализа. Химическая идентификация анионов.
Примечание: К зачету относятся вопросы 1 – 25, к экзамену – все вопросы.
 2018-01-21
2018-01-21 1502
1502








