Осадок образуется в том случае, если произведение концентраций ионов в растворе больше произведения растворимости этих ионов.
Если же произведение концентраций ионов в растворе меньше произведения растворимости – осадок не выпадает.
№21
Одним из важнейших условий сохранения гомеостаза организма является поддержание в его жидких средах кислотно-основного состояния (баланса, равновесия), т.е. соотношения между активными массами водородных и гидроксильных ионов в узких пределах колебаний. От указанного соотношения зависят активность ферментов и, следовательно, интенсивность и направленность метаболических процессов, проницаемость мембран и чувствительность рецепторов клеток, физико-химические свойства их коллоидов и межклеточных структур и т. д.
Изменения рН среды, характеризующей кислотно-основной баланс, могут вести к нарушениям физиологических процессов. Поэтому величина рН является одной из самых жестких констант: рН капиллярной крови здорового человека колеблется в пределах 7,35-7,45. Это постоянство обеспечивается буферными системами (бикарбонатной, фосфатной, белковой), функциями легких, почек, печени, желудка, кишечника, интегрированными деятельностью нервной системы.
Нарушения кислотно-основного состояния (ацидозы и алкалозы) могут быть различного происхождения, в т.ч. могут возникать вследствие либо избыточного, либо недостаточного поступления в организм «кислых» и «щелочных» пищевых продуктов.
Буферными называют растворы, рН которых практически на изменяется от добавления к ним небольших количеств сильной кислоты или щелочи, а также при разведении. Простейший буферный раствор – это смесь слабой кислоты и соли, имеющей с этой кислотой общий анион (например, смесь уксусной кислоты СН3СООН и ацетата натрия СН3СООNa), либо смесь слабого основания и соли, имеющей с этим основанием общий катион (например, смесь гидроксида аммония NH4OH с хлоридом аммония NH4Cl).
Значение рН кислотно-основного буферного раствор зависит от концентраций компонентов буферной смеси, находящихся в химическом равновесии, и мало меняется при концентрировании и разбавлении раствора, введении относительно небольших количеств веществ, взаимодействующих с одним из компонентов буферного раствора.
Наиболее распространены водные кислотно-основные буферные растворы Они содержат слабую кислоту НА и сопряженное с ней основание А, например СН3СООН и СН3СОО-, NH4+ и NH3. В таких системах осуществляется равновесие:
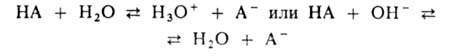
По данным о константе диссоциации кислоты Ка = — [Н3О+] [А- ] /[НА] определяют значение рН раствора:
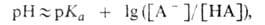
где [НА] и [А-] - равновесные концентрации соответственно кислоты и основания, рКа=—lgКа. Это значение рН остается практически постоянным, так как при добавлении небольших кол-в сильных кислот или оснований ионы Н3О+ или ОН-связываются основанием (к-той) с образованием сопряженной кислоты (основания).
Количественно буферный раствор характеризуется буферной емкостью - производной 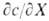 , где X - характеристика среды, с - концентрация одного из компонентов буферной смеси или добавленного вещества, количественно реагирующего с одним из компонентов с образованием другого.
, где X - характеристика среды, с - концентрация одного из компонентов буферной смеси или добавленного вещества, количественно реагирующего с одним из компонентов с образованием другого.
Емкость кислотно-основного буферного раствора соответствует числу эквивалентов сильной кислоты или сильного основания, которое необходимо добавить к 1 л раствора, чтобы изменить его рН на единицу. Буферная емкость возрастает при увеличении начальных концентраций его компонентов и максимальна при их равенстве. Буферные свойства проявляются очень слабо, если концентрация одного компонента в 10 раз и более отличается от концентрации другого. Поэтому буферный раствор часто готовят смешением растворов равной концентрации обоих компонентов либо прибавлением к раствору одного компонента соответствующего количества реагента, приводящего к образованию равной концентрации сопряженной формы.
Состав и механизм: Буферные растворы - это смеси слабого основания или слабой кислоты и их соли. В буферных растворах главными «действующими» компонентами являются донор и акцептор протонов, согласно теории Брёнстеда, или донор и акцептор электронной пары, согласно теории Льюиса, представляющие собой кислотно-основную пару.
По принадлежности слабого электролита буферной системы к классу кислот или оснований и по типу заряженной частицы они делятся на три типа: кислотный, основной и амфолитный. Раствор, содержащий одну или несколько буферных систем, называется буферным раствором.
| CH3COONa + HCl = NaCl + CH3COOH | – молекулярное уравнение | |||
| CH3COO– + Na+ + H+ + Cl– = Na+ + Cl– + CH3COOH | – полное ионное уравнение | |||
| H+ + CH3COO– = CH3COOH | – сокращенное ионное уравнение | |||
Сущность буферного действия смеси слабой кислоты с ее солью можно рассмотреть на примере ацетатного буферного раствора. При добавлении к нему сильной кислоты (например, HCl) происходит реакция:
В результате этого воздействия сильная кислота замещается на эквивалентное количество плохо диссоциированной слабой кислоты буферной системы, поэтому концентрация ионов Н+(активная кислотность) в растворе существенно не изменяется.
Пока солевая компонента буферной системы не расходуется в данной реакции, раствор в той или иной степени будет сохранять свое буферное действие.
При добавлении к буферной смеси сильного основания (например, NaOH) происходит реакция:
| CH3COOH + NaOH = CH3COONa + H2O | – молекулярное уравнение |
| CH3COOH + Na+ + OH– = CH3COO– + Na+ + H2O | – полное ионное уравнение |
| CH3COOН + OH– = CH3COO– + H2O | – сокращенное ионное уравнение |
 2018-01-21
2018-01-21 529
529








