Образование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и других веществ сопровождается 1) уменьшением энергии по сравнению с невзаимодействующими атомами. 2)При этом минимальной энергии соответствует определенное расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности.
Силы, удерживающие атомы в новых образованиях, получили обобщенное название «химическая связь». Важнейшие виды химической связи: ионная, ковалентная, металлическая
Согласно электронной теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору)
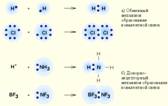
Ионная связь образуется при передаче электронов более электроотрицательному атому, т.е. за счёт электростатического притяжения разноимённо заряженных ионов. Ионы могут быть как простыми, так и сложными. Все ионные соединения имеют в твёрдом состоянии ионную кристаллическую решётку, в которой каждый ион окружён несколькими ионами противоположного знака.При этом все связи данного иона с соседними ионами равноценны, так что весь кристалл можно рассматривать как единую "молекулу". В ионных соединениях не происходит полного разделения зарядов на + и -, т.е. полного перехода электрона от одного атома к другому. Это можно объяснить взаимной поляризацией ионов, т.е. влиянием их друг на друга, которое приводит к деформации электронных оболочек. Поляризация ионов оказывает заметное влияние на свойства образуемых ими соединений (н-р: на диссоциацию солей в водных растворах
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
 2018-01-21
2018-01-21 741
741








