Если у атома в образовании химических связей участвуют разные по типу атомных орбиталей. АО (s-, p-, d- или f-АО), то химические связи формируются электронами не «чистых», а «смешанных», или гибридных орбиталей. Гибридизация - смешение АО с разными (но близкими) энергетическими состояниями, вследствие которого возникает такое же число одинаковых по форме и энергии орбиталей, симметрично расположенных в пространстве. Явление гибридизации основано на таком свойстве ковалентной связи, как направленность.
Перекрывание гибридных АО происходит в большей степени, чем негибридных орбиталей => химические связи прочнее => молекула более устойчива. (рис ниже)
Когда идёт распаривание электронных облаков атом переходит в возбуждённое состояние
Осн сост атома - энергетически стабильн состояние, когда атом не подвергается сильным внешним воздейств. В основ сост атом может находиться долго.
Возбужденное состояние атома - энергетически нестабильное состояние, в которое атом переходит, получая энергию извне. В возбужденном состоянии атом может пребывать лишь короткое время. Возбужденный атом, отдавая энергию, возвращается в основное состояние.
Процесс, приводящий к увеличению числа неспаренных электронов в атомах молекулы с целью увеличе-ния числа возможных ковалентных связей, называется возбуждением атома. Это возможно при затрате оп-ределённого количества энергии.
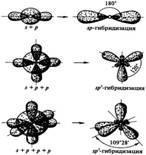
Sp –линейная, sp2- плоский треугольник, sp3-тетраэдр.
 2018-01-21
2018-01-21 906
906








