Поверхность этих металлов тормозит реакцию выделения водорода, что проявляется в большей величине перенапряжения водорода.
Ni2+ +2e=Ni 1
2H2O + 2e=H2 + 2OH- 2
Начиная с плотности тока i потенциал реакции 1 стал больше потенциала реакции 2. В этом случае на катоде протекают обе реакции. Ряд стандартных потенциалов разделен на 3 группы. Из водных растворов металл не выделяется. От Al – H2 –совместное выделение металла и водорода, после H2 – выделение только металла.
2H+ + 2e=H2 pH<7
2H2O + 2e=H2 + 2OH pH>=7
2H2O – 4e = O2+ 4H pH <=7
4OH – 4e = O + 2H2O pH>7
1 закон Фарадея.
Масса прореагировавшего на электроде вещества прямо-пропорциональна количеству электричества. 
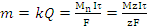
k-электро-химический эквивалент.
Q-количество электричества.
Mn-молярная масса эквивалента.
I-сила тока.
τ-время.
F-число Фарадея 26,8 А/ч моль.
M-молярная атомная масса.
z-число электронов.
Закон Фарадея.
Масса прореагировавших на электродах веществ пропорциональна их эквивалентам.
m1\Mn1=m2\Mn2
ВТ-выход по току.
ВТ=mпрореагир\mрасч *100%
mпрореагир-масса вещества, выделившегося на электроде.
mрасч-масса вещества рассчитанного по формуле.
Рафинирование металлов.
Анодную плотность тока выбираем такой, чтобы происходило окисление Al и металла с большим потенциалом. Оставшемся на аноде. Катодную плотность тока выбираем такой, чтобы происходило восстановление наименьшего алюминия, т.е. металла с меньшим потенциалом оставшимся в электролите.
 2018-01-21
2018-01-21 680
680








