 Углеводороды — наиболее простые органические соединения, молекулы которых построены только из двух элементов — углерода и водорода. По характеру связей между углеродными атомами алифатические углеводороды могут быть предельными (насыщенными) и непредельными (ненасыщенными).
Углеводороды — наиболее простые органические соединения, молекулы которых построены только из двух элементов — углерода и водорода. По характеру связей между углеродными атомами алифатические углеводороды могут быть предельными (насыщенными) и непредельными (ненасыщенными).
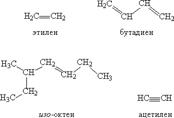
Ненасыщенные углеводороды имеют те же варианты строения основной цепи, что и насыщенные, но содержат двойные или тройные связи между атомами углерода (рис. 6). Простейший ненасыщенный углеводород – этилен.
Алкены, или олефины — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. Алкены содержат в своей молекуле меньшее количество водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными. Номенклатура. По систематической номенклатуре родовое название этиленовых углеводородов — алкены. Названия отдельных гомологов по этой номенклатуре производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (этан — этен, пропан — пропен, бутан — бутен и т.д.). Изомерия. Для алкенов характерны два вида структурной изомерии. Кроме изомерии, связанной со строением углеродной цепи (изомерия углеродного скелета), появляется изомерия, которая зависит от положения двойной связи в этой цепи (изомерия положения). Помимо структурной изомерии в ряду этиленовых углеводородов возможен еще один вид изомерии — цис-, транс-изомерия. Алкены легче воды и плохо растворимы в ней (однако лучше, чем соответствующие алканы), но хорошо — в органических растворителях. Пары алканов имеют характерный резкий запах. Алкены малополярны, но легко поляризуются. Этилен и пропилен горят слегка коптящим пламенем. Алкены в отличие от алканов обладают высокой химической активностью. Их свойства определяются двойной углеродной связью, состоящей из сигма- и пи-связей. Пи-Связь как наименее прочная и более доступная при действии реагента разрывается, а освободившиеся валентности атомов углерода затрачиваются на присоединение атомов, из которых состоит молекула реагента. Для алкенов наиболее типичны реакции присоединения. Двойная связь, имеющая высокую электронную плотность, обычно выступает в качестве донора электронов. Поэтому реакции присоединения, протекая по гетеролитическому типу, являются реакциями эяектрофильного присоединения. Алкены вступают также в реакции полимеризации и окисления. Диеновые углеводороды(алкадиены, или диолефины) — непредельные органические соединения, содержащие в молекуле две двойные связи, Молекулы диеновых углеводородов содержат на два атома водорода меньше, чем молекулы алкенов. Поэтому общая формула диеновых углеводородов СnН2n-2. Номенклатура, По систематической номенклатуре диеновые углеводороды называют, как и этиленовые, но заменяют суффикс -ен на -диен (две двойные связи). Изомерия. Изомерия диенов зависит от различного положения двойных связей в углеродной цепи и от строения углеродного скелета. Диены, содержащие в молекуле несопряженные (изолированные) двойные связи, проявляют свойства обычных алкенов. В то же время десны с сопряженными двойными связями обладают высокой реакционной способностью и отличаются рядом особенностей. Однако для lex и других диеновых углеводородов характерны прежде всего реакции присоединения.
Алкины {ацетилены) — алифатические непредельные углеводоро-i, в молекулах которых между атомами углерода имеется одна тройная связь. Алкины образуют гомологический ряд с общей формулой С„Н2п_2.Номенклатура. По названию первого представителя гомологического ряда алкинов — ацетилена — эти углеводороды называют ацети-ювыми.По систематической номенклатуре алкины называют, заменяя суф-)икс -ан (в алканах) на суффикс -ин. Изомерия. Изомерия алкиновых углеводородов определяется стро-ки углеродной цепи и положением в ней тройной связи. от двух до четырех углеродных атомов— газы, начиная с С5Н8 — жидкости, а высшие алкины (с Ci6H30 и выше) — твердые вещества. Положение тройной связи существенно влияет на температуру кипения Химические свойства алкинов определяются тройной связью и осо-жностью ее строения. Алкины способны вступать в реакции присое-1ения, замещения, полимеризации и окисления.
 2018-01-21
2018-01-21 1514
1514








