Крупнейшим событием в развитии органической химии было создание в 1961 г. великим русским ученым А.М. Бутлеровым теории химического строения органических соединений.
До А.М. Бутлерова считалось невозможным познать строение молекулы, т. е. порядок химической связи между атомами. Многие ученые даже отрицали реальность атомов и молекул.
А.М. Бутлеров опроверг это мнение. Он исходил из правильных материалистических и философских представлений о реальности существования атомов и молекул, о возможности познания химической связи атомов в молекуле. Он показал, что строение молекулы можно установить опытным путем, изучая химические превращения вещества. И наоборот, зная строение молекулы, можно вывести химические свойства соединения.
Теория химического строения объясняет многообразие органических соединений. Оно обусловлено способностью четырехвалентного углерода образовывать углеродные цепи и кольца, соединяться с атомами других элементов и наличием изомерии химического строения органических соединений. Эта теория заложила научные основы органической химии и объяснила ее важнейшие закономерности. Основные принципы своей теории А.М. Бутлеров изложил в докладе «О теории химического строения».
Основные положения теории строения сводятся к следующему:
1) в молекулах атомы соединены друг с другом в определенной последовательности в соответствии с их валентностью. Порядок связи атомов называется химическим строением;
2) свойства вещества зависят не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены между собой, т. е. от химического строения молекулы;
3) атомы или группы атомов, образовавшие молекулу, взаимно влияют друг на друга.
В теории химического строения большое внимание уделяется взаимному влиянию атомов и групп атомов в молекуле.
Химические формулы, в которых изображен порядок соединения атомов в молекулах, называются структурными формулами или формулами строения.
Значение теории химического строения А.М. Бутлерова:
1) является важнейшей частью теоретического фундамента органической химии;
2) по значимости ее можно сопоставить с Периодической системой элементов Д.И. Менделеева;
3) она дала возможность систематизировать огромный практический материал;
4) дала возможность заранее предсказать существование новых веществ, а также указать пути их получения.
Теория химического строения служит руководящей основой во всех исследованиях по органической химии.
12 Фенолы, оксипроизводные ароматических соединений, содержащие одну или несколько гидроксильных групп (– OH), связанных с атомами углерода ароматического ядра. По числу ОН-групп различают одноатомные Ф., например оксибензол C6H5OH, называется обычно просто фенолом, окситолуолы CH3C6H4OH – так называемые крезолы, оксинафталины – нафтолы, двухатомные, например диоксибензолы C6H4(OH)2 (гидрохинон, пирокатехин, резорцин), многоатомные, например пирогаллол, флороглюцин. Ф. – бесцветные с характерным запахом кристаллы, реже жидкости; хорошо растворимы в органических растворителях (спирт, эфир, оензол). Обладая кислотными свойствами, Ф. образуют солеобразные продукты – феноляты: ArOH + NaOH (ArONa + H2O (Ar – ароматический радикал). Алкилирование и ацилирование фенолятов приводит к эфирам Ф. – простым ArOR и сложным ArOCOR (R – органический радикал). Сложные эфиры могут быть получены непосредственным взаимодействием Ф. с карбоновыми кислотами, их ангидридами и хлорангидридами. При нагревании фенолов с CO2 образуются фенолокислоты, например салициловая кислота. В отличие от спиртов, гидроксильная группа Ф. с большим трудом замещается на галоген. Электрофильное замещение в ядре Ф. (галогенирование, нитрование, сульфирование, алкилирование и др.) осуществляется гораздо легче, чем у незамещённых ароматических углеводородов; замещающие группы при этом направляются в орто - и пара -положения к ОН-группе (см. Ориентации правила). Каталитическое гидрирование Ф. приводит к алициклическим спиртам, например C6H5OH восстанавливается до циклогексанола. Для Ф. характерны также реакции конденсации, например с альдегидами и кетонами, что используется в промышленности для получения феноло- и резорцино-формальдегидных смол, дифенилолпропана и др. важных продуктов.
Получают Ф., например, гидролизом соответствующих галогенопроизводных, щелочным плавлением арилсульфокислот ArSO2OH, выделяют из каменно-угольной смолы, дёгтя бурых углей и др. Ф. – важное сырьё в производстве различных полимеров, клеев, лакокрасочных материалов, красителей, лекарственных препаратов (фенолфталеин, салициловая кислота, салол), поверхностноактивных и душистых веществ. Некоторые Ф. применяют как антисептики и антиокислители (например, полимеров, смазочных масел). Для качественной идентификации Ф. используют растворы хлорного железа, образующие с Ф. окрашенные продукты. Ф. токсичны (см. Сточные воды.).
13 Алканы
| Предельные углеводороды |
Углеводороды - простейшие органические соединения, состоящие из двух элементов: углерода и водорода. Предельными углеводородами, или алканами (международное название), называются соединения, состав которых выражается общей формулой С n Н2n+2, где n - число атомов углерода. В молекулах предельных углеводородов атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода. Алканы называют также насыщенными углеводородами или парафинами (Термин «парафины» означает «имеющие малое сродство»).
Первым членом гомологического ряда алканов является метан СН4. Окончание -ан является характерным для названий предельных углеводородов. Далее следует этан С2Н6, пропан С3Н8, бутан С4Н10. Начиная с пятого углеводорода, название образуется из греческого числительного, указывающего число углеродных атомов в молекуле, и окончания -ан. Это пентан С5Н12 гексан С6Н14, гептан С7Н16, октан С8Н18, нонан С9Н20, декан С10Н22 и т. д.
В гомологическом ряду наблюдается постепенное изменение физических свойств углеводородов: повышаются температуры кипения и плавления, возрастает плотность. При обычных условиях (температура ~ 22°С) первые четыре члена ряда (метан, этан, пропан, бутан) — газы, с С5Н12 до С16Н34 - жидкости, а с С17Н36 — твердые вещества.
Алканы, начиная с четвертого члена ряда (бутана), имеют изомеры.
Все алканы насыщены водородом до предела (максимально). Их атомы углерода находятся в состоянии sp 3 —гибридизации, а значит, имеют простые (одинарные) связи.
Номенклатура
Названия первых десяти членов ряда предельных углеводородов уже даны. Чтобы подчеркнуть, что алкан имеет неразветвленную углеродную цепь, часто к названию добавляют слово нормальный (н-), например:
СН3—СН2—СН2—СН3 СН3—СН2—СН2—СН2—СН2—СH 2 —СН3
н-бутан н-гептан
(нормальный бутан) (нормальный гептан)
При отрыве атома водорода от молекулы алкана образуются одновалетные частицы, называемые углеводородными радикалами (сокращенно обозначаются буквой R). Названия одновалентных радикалов производятся от названий соответствующих углеводородов с заменой окончания –ан на -ил. Вот соответствующие примеры:
| Углеводороды | |||
| Метан | CH 4 | Гексан | C 6 H 14 |
| Этан | C 2 H 6 | Гептан | C 7 H 16 |
| Пропан | C 3 H 8 | Октан | C 8 H 18 |
| Бутан | C 4 H 10 | Нонан | C 9 H 20 |
| Пентан | C 5 H 12 | Декан | C 10 H 22 |
| Одновалентные радикалы | |||
| Метил | CH 3 - | Гексил | C 6 H 13 - |
| Этил | C 2 H 5 - | Гептил | C 7 H 15 - |
| Пропил | C 3 H 7 - | Октил | C 8 H 17 - |
| Бутил | C 4 H 9 - | Нонил | C 9 H 19 - |
| Пентил (амил) | C 5 H 11 - | Децил | C 10 H 21 - |
Радикалы образуются не только органическими, но и неорганическими соединениями. Так, если от азотной кислоты отнять гидроксильную группу ОН, то получится одновалентный радикал — NO2, называемый нитрогруппой, и т. д.
При отнятии от молекулы углеводорода двух атомов водорода получаются двухвалентные радикалы. Их названия также производятся от названий соответствующих предельных углеводородов с заменой окончания -ан на -илиден (если атомы водорода оторваны от одного атома углерода) или -илен (если атомы водорода оторваны от двух соседних атомов углерода). Радикал СН2= имеет название метилен.
Названия радикалов используются в номенклатуре многих производных углеводородов. Например: СН3I - йодистый метил, С4Н9Сl -хлористый бутил, СН 2Сl 2 - хлористый метилен, С2Н4Вr 2 - бромистый этилен (если атомы брома связаны с разными атомами углерода) или бромистый этилиден (если атомы брома связаны с одним атомом углерода).
Для названия изомеров широко применяют две номенклатуры: старую - рациональную и современную - заместительную, которую также называют систематической или международной (предложена Международным союзом теоретической и прикладной химии ИЮПАК).
По рациональной номенклатуре углеводороды рассматриваются как производные метана, у которого один или несколько атомов водорода замещены на радикалы. Если в формуле одинаковые радикалы повторяются несколько раз, то их указывают греческими числительными: ди - два, три - три, тетра - четыре, пента - пять, гекса - шесть и т. д. Например:

Рациональная номенклатура удобна для не очень сложных соединений.
По заместительной номенклатуре основой для названия служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются как заместители. В этом случае выбирают наиболее длинную цепь углеродных атомов и атомы цепи нумеруют с того конца, к которому ближе стоит углеводородный радикал. Затем называют: 1) номер углеродного атома, с которым связан радикал (начиная с простейшего радикала); 2) углеводород, которому соответствует длинная цепь. Если в формуле содержится несколько одинаковых радикалов, то перед их названием указывают число прописью (ди-, три-, тетра- и т. д.), а номера радикалов разделяют запятыми. Вот как по этой номенклатуре следует назвать изомеры гексана:


А вот более сложный пример:

Как заместительная, так и рациональная номенклатура применяются не только для углеводородов, но и для других классов органических соединений. Для некоторых органических соединений используются исторически сложившиеся (эмпирические) или так называемые тривиальные названия (муравьиная кислота, серный эфир, мочевина и др.).
При написании формул изомеров легко заметить, что атомы углерода занимают в них неодинаковое положение. Атом углерода, который связан только с одним атомом углерода в цепи, называется первичным, с двумя - вторичным, с тремя - третичным, с четырьмя - четвертичным. Так, например, в последнем примере атомы углерода 1 и 7 - первичные, 4 и 6 - вторичные, 2 и 3 - третичные, 5 - четвертичный. Свойства атомов водорода, других атомов и функциональных групп зависят от того, с каким углеродным атомом они связаны: с первичным, вторичным или третичным. Это всегда надо учитывать.
Получение. Свойства.
Физические свойства. В обычных условиях первые четыре члена гомологического ряда алканов (С1 — С4) — газы. Нормальные алканы от пентана до гептадекана (C5 — C17) — жидкости, начиная с С18 и выше — твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды, они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан и др. Жидкие алканы легко смешиваются друг с другом.
Основные природные источники алканов — нефть и природный газ. Различные фракции нефти содержат алканы от C5H12 до С30Н62. Природный газ состоит из метана (95%) с примесью этана и пропана.
Из синтетических методов получения алканов можно выделить следующие:
1. Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом ("гидрирование") происходит в присутствии металлических катализаторов (Ni, Pd) при
нагревании:
| tº. Ni | ||
| СН3-СН=СН2 + Н2 | → | СН3-СН2-СН3, |
СНз-C≡СН + 2Н2 → СН3-СН2-СН3.
2. Получение из галогенпротводных. При нагревании моногалогензамещенных алканов с металлическим натрием получают алканы с удвоенным числом атомов углерода (реакция Вюрца):
С2Н5Br + 2Na + Br-C2H5 → C2H5-C2H5 + 2NaBr.
Подобную реакцию не проводят с двумя разными галогензамещенными алканами, поскольку при этом получается смесь трех различных алканов
3. Получение из солей карбоновых кислот. При сплавлении безводных солей карбоновых кислот с щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:
| t° | ||
| CH3COONa + NaOH | → | СН4↑ + Na2CO3. |
4.Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:
С + 2Н2 → СН4.
Такая же реакция идет при нагревании углерода в атмосфере водорода до 400-500 °С при повышенном давлении в присутствии катализатора.
В лабораторных условиях метан часто получают из карбида алюминия:
Аl4С3 + 12Н2О = ЗСН4↑ + 4Аl(ОН)3.
Химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями - перманганатом калия KMnО4 и т.п.
Химическая устойчивость алканов объясняется высокой прочностью s-связей С-С и С-Н, а также их неполярностью. Неполярные связи С-С и С-Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов. Следовательно, алканы вступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом SR (от англ, substitution radicalic). По этому механизму легче всего замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
1. Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов. Общая схема этой реакции показана на примере метана:
<> <>
| Сl2 | Сl2 | Сl2 | Сl2 | |||||||
| СН4 | → | СН3Сl | → | СН2Сl2 | → | СНСl3 | → | ССl4 | (*) | |
| -HCl | -HCl | -НСl | -HCl |
Реакция образования хлорметана протекает по цепному механизму, который характеризуется следующими стадиями:
а) инициирование цепи:
| hv | ||
| Сl2 | → | 2Сl· |
б) Рост цепи. Радикал хлора отнимает у молекулы алкана атом водорода:
Cl·+ СН4→НСl + СН3·
При этом образуется алкильный радикал, который отнимает атом хлора у молекулы хлора:
СН3· + Сl2→СН3Сl + Сl·
Эти реакции повторяются до тех пор, пока не произойдет обрыв цепи по одной из реакций:
Cl· + Cl· → Сl2, СН3· + СН3· → С2Н6, СН3· + Cl· → СН3Сl·
Суммарное уравнение реакции:
| hv | ||
| СН4 + Сl2 | → | СН3Сl + НСl. |
Образующийся хлорметан может подвергаться дальнейшему хлорированию, давая смесь продуктов CH2Cl2, CHCl3, ССl4 по схеме (*).
Развитие теории цепных свободнорадикальных реакций тесно связано с именем выдающегося русского ученого, лауреата Нобелевской премии Н.И. Семенова (1896-1986).
2. Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140°С и небольшом давлении протекает радикальная реакция:
| t ° | ||
| CH3-CH3 + HNO3 | → | CH3-CH2-NO2 + H2O. |
При радикальных реакциях (галогенирование, нитрование) в первую очередь замешаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода. Это объясняется тем, что легче всего разрывается гомолитически связь третичного атома углерода с водородом (энергия связи 376 кДж/моль), затем — вторичного (390 кДж/моль) и только потом — первичного (415 кДж/моль).
3. Изомеризация. Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:

4. Крекинг — это гемолитический разрыв связей С-С, который протекает при нагревании и под действием катализаторов.
При крекинге высших алканов образуются алкены и низшие алканы, при крекинге метана и этана образуются ацетилен:
C8H18 → C4H10 + С4Н8,
2СН4 → С2Н2 + ЗН2,
С2Н6 → С2Н2 + 2Н2.
Эти реакции имеют большое промышленное значение. Таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты.
5. Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
 |
Мягкое каталитическое окисление бутана кислородом воздуха - один из промышленных способов получения уксусной кислоты:
t°
2C4H 10 + 5O2 → 4CH3COOH + 2Н2О.
кат
На воздухе алканы сгорают до СО2 и Н2О:
СnН2n+2 + (Зn+1)/2О2 = nСО2 + (n+1)Н2О.
Алкены
Алкены (иначе олефины или этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации.
Простейшим алкеном является этен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Гомологический ряд
Алкены, число атомов углерода в которых больше трёх, имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая.
| этен | C2H4 |
| пропен | C3H6 |
| н-бутен | C4H8 |
| н-пентен | C5H10 |
| н-гексен | C6H12 |
| н-гептен | C7H14 |
| н-октен | C8H16 |
| н-нонен | C9H18 |
| н-децен | C10H20 |
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Алкены химически активны. Их химические свойства определяются наличием двойной связи.
Озонолиз: алкен окисляется до альдегидов (в случае монозамещенных вицинальных углеродов), кетонов (в случае дизамещенных вицинальных углеродов) или смеси альдегида и кетона (в случае три-замещенного у двойной связи алкена):
R1–CH=CH–R2 + O3 → R1–C(H)=O + R2C(H)=O + H2O
R1–C(R2)=C(R3)–R4+ O3 → R1–C(R2)=O + R3–C(R4)=O + H2O
R1–C(R2)=CH–R3+ O3 → R1–C(R2)=O + R3–C(H)=O + H2O
Озонолиз в жёстких условиях — алкен окисляется до кислоты:
R'–CH=CH–R" + O3 → R'–COOH + R"–COOH + H2O
Присоединение по двойной связи:
CH2=CH2 +Br2 → CH2Br-CH2Br
Окисление надкислотами:
CH2=CH2 + CH3COOOH → 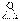
или
CH2=CH2 + HCOOH → HOCH2CH2OH
 2018-01-21
2018-01-21 9060
9060
