| Функция | Пояснение |
| Структурная | Аминокислоты являются структурными звеньями пептидов и полипептидов. Белки всех живых организмов на Земле построены из 20 видов аминокислот. Некоторые аминокислоты и их производные входят в состав пуриновых и пиримидиновых оснований, коферментов, желчных кислот, антибиотиков и др. |
| Сигнальная | Некоторые из аминокислот являются нейромедиаторами или предшественниками медиаторов |
15 АЛЬДЕГИДЫ И КЕТОНЫ – органические соединения (см. ХИМИЯ ОРГАНИЧЕСКАЯ), содержащие фрагмент >C=O (углерод, связанный двойной связью с кислородом, его называют карбонильным). У альдегидов карбонильный углерод соединен с атомом Н и органической группой R (общая формула RHC=O), а в кетонах – с двумя органическими группами (общая формула R2С=О).
Номенклатура альдегидов и кетонов. Группу –(Н)С=О называют альдегидной, для связывания с органическими группами у нее есть всего одна свободная валентность, это позволяет ей находится только на конце углеводородной цепи (но не в середине). При составлении названия альдегида указывается название соответствующего углеводорода, к которому добавляется суффикс «аль», например, метаналь Н2С=О, этаналь Н3СС(Н)=О, пропаналь Н3ССН2С(Н)=О. В более сложных случаях углеродную цепь группы R нумеруют, начиная с карбонильного углерода, затем с помощью числовых индексов указывают положение функциональных групп и различных заместителей.

Рис. 1. НОМЕНКЛАТУРА АЛЬДЕГИДОВ. Замещающие и функциональные группы, а также соответствующие им цифровые индексы выделены различающимися цветами.
Для некоторых альдегидов часто используют тривиальные (упрощенные) названия, сложившиеся исторически, например, формальдегид Н2С=О, ацетальдегид Н3СС(Н)=О, кротоновый альдегид СН3СН=CHC(H)=O.
В отличие от альдегидной, кетонная группа >C=O может находиться также в середине углеводородной цепи, поэтому в простых случаях указывают названия органических групп (упоминая их в порядке увеличения) и добавляют слово «кетон»: диметилкетон CH3–CO–CH3, метилэтилкетон CH3CH2–CO–CH3. В более сложных случаях положение кетонной группы в углеводородной цепи указывают цифровым индексом, добавляя суффикс «он». Нумерацию углеводородной цепи начинают с того конца, который находится ближе к кетонной группе (рис. 2).

Рис. 2. НОМЕНКЛАТУРА КЕТОНОВ. Замещающие и функциональные группы и соответствующие им цифровые индексы выделены различными цветами.
Для простейшего кетона CH3–CO–CH3 принято тривиальное название – ацетон.
Химические свойства альдегидов и кетонов определяются особенностями карбонильной группы >C=O, обладающей полярностью – электронная плотность между атомами С и О распределена неравномерно, сдвинута к более электроотрицательному атому О. В результате карбонильная группа приобретает повышенную реакционную способность, что проявляется в разнообразных реакциях присоединения по двойной связи. Во всех случаях кетоны менее реакционноспособны, чем альдегиды, в частности, из-за пространственных затруднений, создаваемых двумя органическими группами R, наиболее легко участвует в реакциях формальдегид Н2С=О.
1. Присоединение по двойной связи С=О.
При взаимодействии со спиртами альдегиды образуют полуацетали – соединения, содержащие одновременно алкокси- и гидрокси-группу у одного атома углерода: >C(OH)OR. Полуацетали могут далее реагировать с еще одной молекулой спирта, образуя полные ацетали – соединения, где у одного атома углерода находятся одновременно две RО-группы: >C(OR)2. Реакцию катализируют кислоты и основания (рис. 3А). В случае кетонов присоединение спиртов к двойной связи в С=О затруднено.
Сходным образом альдегиды и кетоны реагируют с синильной кислотой HCN, образуя гидроксинитрилы – соединения, содержащие у одного атома углерода ОН- и CN-группу: >C(OH)CºN (рис. 3Б). Реакция примечательна тем, что позволяет увеличивать углеродную цепь (возникает новая связь С-С).
Точно так же (раскрывая двойную связь С=О) аммиак и амины реагируют с альдегидами и кетонами, продукты присоединения неустойчивы и конденсируются с выделением воды и образованием двойной связи C=N. В случае аммиака получаются имины (рис. 3В), а из аминов образуются так называемые основания Шиффа – соединения, содержащие фрагмент >C=NR (рис. 3Г). Продукт взаимодействия формальдегида с аммиаком несколько иной – это результат циклизации трех промежуточных молекул, в результате получается каркасное соединение гексаметилентетрамин, используемое в медицине как препарат уротропин (рис. 3Д).

2. Реакции конденсации. Для альдегидов и кетонов возможна конденсация, проходящая между двумя молекулами одного и того же соединения. При такой конденсации альдегидов двойная связь одной из молекул раскрывается, образуется соединение, содержащее одновременно альдегидную и ОН-группу, называемое альдолем (альдегидоспирт). Протекающую конденсацию называют, соответственно, альдольной, эту реакцию катализируют основания (рис. 4А). Полученный альдоль может далее конденсироваться с образованием двойной связи С=С и выделением конденсационной воды. В итоге получается ненасыщенный альдегид (рис. 4А, кротоновой альдегид). Такую конденсацию называют кротоновой по названию первого соединения в ряду ненасыщенных альдегидов. Кетоны также способны участвовать в альдольной конденсации (рис. 4Б), а вторая стадия – кротоновая конденсация, для них затруднена. В альдольной конденсации могут совместно участвовать молекулы различных альдегидов, а также одновременно альдегид и кетон, во всех случаях происходит удлинение углеродной цепи. Получившийся на последней стадии (рис. 4А) кротоновый альдегид, обладая всеми свойствами альдегидов, может далее участвовать в альдольной и кротоновой конденсации при взаимодействии с очередной порцией ацетальдегида, из которого он и был получен (рис. 4В). Таким способом можно удлинять углеводородную цепь, получая соединения, в которых чередуются простые и двойные связи: –СН=СН–СН=СН–.

Конденсация альдегидов и кетонов с фенолами идет с удалением карбонильного атома О (в виде воды), а метиленовая группа СН2 или замещенная метиленовая группа (СНR либо СR2) встраивается между двумя молекулами фенола. Наиболее широко эту реакцию применяют для получения фенолоформальдегидных смол (рис. 5.).

16 Ароматические амины
назад
Ароматические амины - соединения, в которых азот аминной группы непосредственно связан с ароматическим кольцом. Ароматические ди- и полиамины, как правило, отверждают эпоксидные смолы при повышенных температурах. При этом образуются эпоксидные полимеры, которые характеризуются высокими показателями прочности и водо- и химстойкости, хорошими теплофизическими и диэлектрическими свойствами. Некоторые ароматические амины способны отверждать эпоксидные смолы и на холоде, однако свойства полимерных материалов при холодном отверждении значительно уступают свойствам полимеров, полученных при нагревании. Связующие с указанными отвердителями позволяют изготавливать термостойкие, высокопрочные изделия из стеклопластиков конструкционного и радиотехнического назначения всеми известными методами: намоткой, прессованием, вакуум-компрессионным формованием, протяжкой, пропиткой под давлением, а также изготавливать препреги. Диамин 304 - низкоплавкая эвтектическая смесь продуктов конденсации ортохлоранилина со смесью форм и бензальдегидов. Время желатинизации со смолой ЭД-20 при температуре 150 °С - 1-1,5 ч, жизнеспособность при температуре 70 °С - 8 ч. Бензам АБА - смесь изомеров аминобензиланилинов, диамино- дифенилметана и высших полиаминобензиланилинов. Вязкое, смолообразное вещество, условная вязкость по ВЗ-4 (диаметр сопла 4 мм) при 55 °С - 90-155 с. Время желатинизации со смолой ЭД-20 при 150 °С — 15 мин, время жизнеспособности при 70 °С - около 2 ч. Дихлорбензам АБА - смесь изомеров дихлораминобензилами- нов и высших хлораминобензиламинов. Вязкое, смолообразное вещество. Условная вязкость по ВЗ-4 (диаметр сопла 4 мм) при 55 °С от 80 до 180 с. Время желатинизации со смолой ЭД-20 при 150 °С - 3,5 ч, время жизнеспособности при 70 °С - 6 ч. Полиамин X - смесь продуктов конденсации ортохлоранилина и формальдегида. Вязкое, смолообразное вещество. Время желатинизации со смолой ЭД-20 при 150 °С — 1 ч, время жизнеспособности при 70 °С - 8-9 ч.
17 Галогеналканы (алкилгалогениды) — органические соединения, которые, как ясно из их названия, содержат в своём составе связь «углерод-галоген». Их строение можно представить, исходя из строения углеводорода, в котором связь С-Н заменена на связь С-Х, (Х — фтор, хлор, бром, иод). В силу того, что атомы галогенов являются более электроотрицательными, чем атом углерода, связь С-Х поляризована таким образом, что атом галогена приобретает частичный отрицательный заряд, а атом углерода — частичный положительный. Таким образом, алкилгалогениды являются ярко выраженными электрофилами, и на этом свойстве основано их применение в органическом синтезе.
Свойства
Химическая активность алкигалогенидов может меняться в широких пределах в зависимости от их строения.
Характерные реакции — нуклеофильное замещение, элиминирование, восстановление до алкана, перегруппировки с участием карбениевых ионов, взаимодействие с щелочными и щёлочноземельными металлами.
Применение
В тонком органическом синтезе и в промышленности наиболее часто встречаются следующие:
18 Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
По международной номенклатуре ИЮПАК, карбоновые кислот называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание " овая " и слово " кислота ". При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН - пропановая кислота, СН3-С(СН3)2-СООН - 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание " карбоновая " и слово " кислота ", не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН - циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН - трет -бутилкарбоновая кислота.
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
ароматические
алифатические (в том числе предельные и непредельные)
алициклические
гетероциклические.
По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
Применение
Карбоновые кислоты - исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов - сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот - пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы - компоненты лаков и пластмассы. Амиды кислот эмульгаторы и флотоагенты.
Получение
- Окисление спиртов

- Окисление альдегидов

- Гидролиз тригалогеналканов

- Карбоксилирование металлорганических соединений

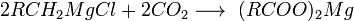
- Гидролиз сложных эфиров

- Гидролиз нитрилов


Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу; удобный лабораторный метод (если нитрил доступен)
- Реакция Арндта-Эйстерта


Используется для получения высших гомологов кислот из низших.
Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты в отличие от спиртов, образуют более прочные водородные связи, вследствие того что связи  в них в большей степени поляризованы по типу
в них в большей степени поляризованы по типу  Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров.
Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров.
Дисахариды
Дисахариды
биозы, углеводы, молекулы которых состоят из двух остатков моносахаридов (См. Моносахариды). Все Д. построены по типу гликозидов (См. Гликозиды). При этом водородный атом гликозидного гидроксила одной молекулы моносахарида замещается остатком др. молекулы моносахарида за счёт полуацетального или спиртового гидроксила. В первом случае образуются Д., не обладающие восстанавливающими свойствами, во втором — Д. с восстанавливающими свойствами (I). В группу невосстанавливающих Д. входят трегалоза (микоза, или грибной сахар), состоящая из 2 остатков глюкозы (См. Глюкоза) (II); Сахароза, состоящая из остатков глюкозы и фруктозы (III), и др. К группе восстанавливающих Д. относятся Мальтоза (IV), Целлобиоза (V), Лактоза (VI) и др. Д. могут содержать 5- и 6-членные кольца моносахаридов (пентозы и гексозы) и различаться по конфигурации гликозидной связи (α- или β-гликозиды). Пространственные формы (конформации (См. Конформация)) колец моносахаридных остатков в разных Д. могут варьировать. Так, целлобиоза и мальтоза различаются не только конфигурацией гликозидной связи (α — у мальтозы и β — у целлобиозы), но и тем, что в целлобиозе оба остатка находятся в одинаковой конформации, а в мальтозе — в разных.
Д. — хорошо кристаллизующиеся вещества, легко растворимы в воде и в 45 — 48°-ном спирте, плохо растворимы в 96°-ном спирте; оптически активны; сладки на вкус. Гидролиз Д. (для сахарозы называется инверсией) происходит при действии кислот; при наличии 5-членного кольца в моносахаридном остатке скорость кислотного гидролиза Д. возрастает. Гидролиз Д. осуществляется также ферментами (карбогидразами), например α- или β-гликозидазами (в зависимости от типа гликозидной связи в Д.). В результате гидролиза образуются моносахариды.
Д. широко распространены в животных и растительных организмах. Они встречаются в свободном состоянии (как продукты биосинтеза или частичного гидролиза полисахаридов), а также как структурные компоненты гликозидов и др. соединений. Обычно Д. получают из природных источников (например, сахарозу — из сахарной свёклы или сахарного тростника, лактозу — из молока животных). Многие Д. синтезируют химическими и биохимическими методами.
Сахароза, лактоза и мальтоза — ценные пищевые и вкусовые вещества. Производством сахарозы занята сахарная промышленность.
Лит.: Химия углеводов, М., 1967; Степаненко Б. Н., Углеводы. Успехи в изучении строения и метаболизма, М., 1968; Staněk J., Černý M., Pacák J., The Oligosaccharides, Prague, 1965.
Б. Н. Степаненко.

Образование невосстанавливающего дисахарида.
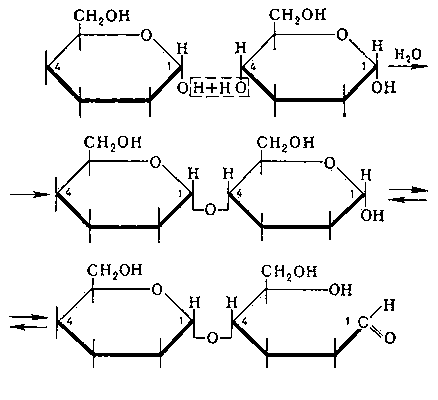
Образование восстанавливающего дисахарида.

Трегалоза.

Сахароза.

Мальтоза.

Целлобиоза.

ДИСАХАРИДЫ (сахароподобные полио-зы, биозы), углеводы, расщепляющиеся при гидролизе (инверсии) с образованием из 1 молекулы Д. 2 молекул моноз. Д. растворимы в воде, давая истинные растворы; большинство хорошо кристаллизуется, имеет сладкий вкус. Остатки моноз соединены в Д. эфирообразно через атом О. Связь между монозами образуется или в результате отщепления воды из обоих гидроксилов при карбонильных группах — дигликозидная связь (I), например в тростниковом сахаре: – сн – но. сн неон но. сн —сн I сн2.он сн2.он I но. сн I неон СНа. ОН фруктоза а - 1 & 1,5 > гликозидо – у-2& 2,5> фрукто-зид, или отщеплением воды из гидроксила при карбонильной группе одной монозы и спиртового гидроксила другой—моногли-козидная связь (II); примером может служить мальтоза:».:-СН-: НО. НС- но. сн неон I I I 1 о неон о но. сн о I I I но. сн I-неон I I -СН ТТ НС- ‘■ I I сн8.он сн2.он а – & 1,5> гликозидо-4& 1,5> глюкоза. При моногликозидной связи (II) остаток моно-зы, сохраняющий карбонильную группу свободной, обнаруживает явление мутаро-тации. Д. типа II обладают восстановительной способностью и реагируют с фенилги-дразином. Д., построенные по типу I, этими свойствами не обладают; их обозначают как гликозидо-гликозиды, при чем цифрами перед названиями моноз указывают места их связи и нумеруют в формулах атомы С, считая от карбонильной группы или ближайшего к ней С-атома. Перед названием монозы, участвующей спиртовым гидрокси-лом в образовании Д. типа II, цифрой обозначают номер С-атома, которому принадлежит этот гидроксил. Номера углеродов, соединенных кислородом в гетероциклическое кольцо, обозначают цифрами в скобках & >. Буквами а или /J указывают, в форме какого диастереоизомера находится моноза; неустойчивые формы их обозначают у. В Д. типа II окончанием «идо» отмечают ту монозу, к-рая участвует в образовании связи своим гидроксилом при карбонильной группе. Из числа различных групп Д., образованных гексозами, особенно важны следующие две. 1. Группа мальтозы общей формулы С12Н22Оц, типа II. Мальтоза, лактоза (см.), целлоза (целлобиоза), /?& 1,5 > гликозидо-4& 1,5 > глюкоза, образуется при неполном гидролизе клетчатки. Генциобиоза, р& 1,5 > гликозидо – 6 & 1,5> глюкоза, есть Д.,’ входящий в молекулу амигдалина, а также получаемый при неполном гидролизе трисахарида генцианозы. 2. Группа трегалозы, общая формула С12Н220ц, типа I. Трегалоза (микоза) а-1& 1,5> гликозидо-а-1& 1,5> гликозид, содержится во многих грибах. Тростниковый сахар (свекловичный сахар, сахароза).—Д., построенные из молекулы гексозы и молекулы пентозы, очень редки. Сюда принадлежит вицианоза СпН20О10, выделенная из гликозида Vicia angustifolia.—С и н т е з Д. производится или хим. путем (действием Ag2C03 на галоидопроизводные ацетили-рованных моноз, конденсацией ацетилиро-ванных моноз, действием кислот на монозы и др.) или биол. путем (из моноз в результате обратной реакции под влиянием тех же ферментов, к-рые вызывают расщепление Д.; так напр. из d-глюкозы получены Д. мальтоза и ревертоза при действии мальтазы дрожжей, генциобиоза и целлобиоза при действии эмульсина; из d-галактозы получена галактобиоза; изолактоза образуется при действии на смесь d-глюкозы и d-ra-лактозы водной вытяжки из зерен кефира). О биологическом и практическом значении Д., об их образовании в организме—см. Углеводы и отдельные дисахариды. Всасывание Д. происходит после их расщепления до моноз соответствующими ферментами, гл-. обр. через кровеносные сосуды кишечных ворсинок. Наиболее сильному расщеплению Д. подвергаются в двенадцатиперстной кишке. При введении с пищей больших количеств Д. они могут всасываться отчасти неизмененными (лактоза, тростниковый сахар); у нек-рых животных лактоза всасывается, не инвертируясь; Д. всасываются медленнее моноз, мальтоза-медленнее тростникового сахара. При кормлении большими количествами Д. понижаются процессы гниения в кишечнике, и вместе с тем могут наступить поносы. При алиментарной гликозурии находили Д. в моче. Лактоза встречается в моче при беременности, при кормлении грудью, у новорожденных телят, у грудных детей при сильных жел.-киш. расстройствах. Д., дающие при расщеплении способные к брожению монозы, переходят в организме животного при введении per os в гликоген. Лактоза является плохим гликогенообра-зователем. При введении в кровь тростниковый сахар и лактоза, не переходя в гликоген, выделяются с мочой; мальтоза, благодаря присутствию в крови мальтазы, в моче не появляется; после повторных парентеральных введений тростникового ил
Альдегиды, кетоны
Органические соединения, в молекуле которых имеется карбонильная группа >С=O, называются карбонильными соединениями, или оксосоединениями. Карбонильные соединения делятся на две большие группы — альдегиды и кетоны.
Альдегиды содержат в молекуле карбонильную группу, связанную с атомом водорода, т. е. альдегидную группу —СН=O. Кетоны содержат карбонильную группу, связанную с двумя углеводородными радикалами, т. е. кетонную группу.
В зависимости от строения углеводородных радикалов альдегиды и кетоны бывают алифатическими, алициклическими и ароматическими.
Изомерия альдегидов связана только со строением радикалов.
Для альдегидов часто используют тривиальные названия, соответствующие названиям кислот(с тем же числом углеродных атомов), в которые альдегиды переходят при окислении. По систематической номенклатуре названия альдегидов образуют, прибавляя окончание -аль к названию родоначального углеводорода с самой длинной углеродной цепью, включающей карбонильную группу, от которой и начинают нумерацию цепи. Названия ароматических альдегидов производят от родоначальной структуры ряда — бензальдегида С6Н5 —СН=О.
Изомерия кетонов связана со строением радикалов и с положением карбонильной группы в углероднойцепи.
Кетоны часто называют по наименованию радикалов, связанных с карбонильной группой, или по систематической номенклатуре: к названию предельного углеводорода добавляют суффикс -он и указывают номер атома углерода, связанного с карбонильным кислородом. Нумерацию начинают с ближайшего к кетонной группе конца цепи.
В молекуле кетона радикалы могут быть одинаковыми или разными. Поэтому кетоны, как и простые эфиры, делятся на симметричные и смешанные.
Способы получения. Исходными соединениями для получения альдегидов и кетонов могут быть углеводороды, галогенопроизводные, спирты или кислоты.
1. Гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей Нg2+ и дает ацетальдегид СН3СНО в случае ацетилена и различные кетоны в случае гомологов ацетилена (см. “Алкины”).
2. Окисление спиртов. При окислении первичных спиртов образуются альдегиды, вторичных — кетоны (см. “Спирты”).
3. Важным промышленным способом получения формальдегида (метаналя) является каталитическое окисление метана кислородом воздуха (см. “Алканы”).
Физические свойства. Оксосоединения не способны образовывать водородные связи, поэтомуих температуры кипения значительно ниже, чем соответствующих спиртов. Температуры кипения кетонов обычно бывают несколько выше, чем изомерныхим альдегидов.
В обычных условиях только формальдегид является газом. Остальные оксосоединения — жидкости или твердые вещества. Формальдегид Н2СО имеет резкий неприятный запах. Средние гомологи ряда альдегидов обладают устойчивым характерным запахом (альдегидный запах). Высшие альдегиды (С7—С16) обладают приятным запахом и широко используются в парфюмерии.
Формальдегид хорошо растворим в воде, его 40%-ный водный раствор называют формалином. Ацеталъдегид (этаналь) СНзСНО также хорошо растворим в воде.
Ацетон (пропанон, или диметилкетон) — бесцветная жидкость, хорошо растворимая в воде, спирте и эфире. Это широко используемый органический растворитель, он хорошо растворяет жиры, смолы и многие другие органические вещества.
Химические свойства. Химические свойства альдегидов и кетонов обусловлены присутствиемв их молекуле активной карбонильной группы, в которой двойная связь сильно поляризована в силу большой электроотрицательности кислорода(>С==О).
В результате на карбонильном атоме углерода (карбанион) возникает заметный положительный заряд. Поэтому для альдегидов и кетонов характерны реакции присоединения по двойной связи С=О. Большинство из них протекает как нуклеофильное присоединение.
Кроме реакции присоединения по карбонильной группе, для альдегидов характерны также реакции с участием a -атомов водорода, соседних с карбонильной группой. Их реакционная способность связана с электроноакцепторным влиянием карбонильной группы, которое проявляется в повышенной полярности связи С—Н. Это приводит к тому, что альдегиды, в отличие от кетонов, легко окисляются. Их взаимодействие с аммиачным раствором оксида серебра является качественной реакцией на альдегиды.
 2018-01-21
2018-01-21 1512
1512