Предельными называются углеводороды, в которых каждый атом углерода затрачивает на соединение с соседними углеродными атомами не более одной единицы валентности. Общая формула углеводородов этого ряда СnН2n+2. Тип гибридизации атома углерода в алканах — sp3.
Изомерия
В ряду алканов наблюдается структурная и конформационная изомерия. Структурная изомерия углеводородного скелета обусловлена различным характером соединения атомов углерода в молекуле:
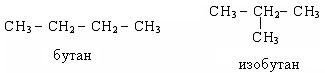
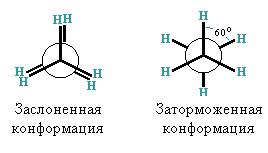
Конформационная изомерия обусловлена возможностью свободного вращения алкильных групп вокруг d-связей и начинается с этана. Для изображения конформаций используются формулы Ньютона.
Номенклатура
Для названия предельных углеводородов используют тривиальные названия, рациональную и систематическую номенклатуры.
Тривиальные названия – это сложившиеся названия органических соединений (метан, этан, пропан, бутан).
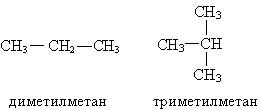
По рациональной номенклатуре алканы рассматриваются как замещенные метана. Чтобы дать название по этой номенклатуре, необходимо назвать радикалы и добавить слово метан.
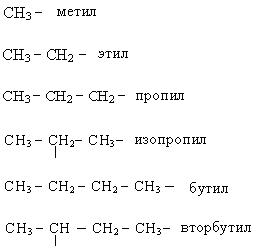
Основные принципы систематической (международной) номенклатуры, или как ее еще называют ИЮПАК, изложены в 1892 году и дополнены в 1957 и в 1965 годах. Для применения систематической номенклатуры необходимо знать названия и строение определенных фрагментов молекул – органических радикалов.
Названия основных радикалов приведены ниже:
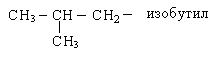
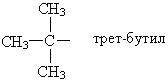
По систематической номенклатуре первые четыре члена ряда алканов сохраняют тривиальные названия. Далее названия даются от латинских и греческих числительных с добавлением окончания «ан».
Чтобы дать название сложному углеводороду, выбирают самую длинную углеводородную цепочку, нумеруют ее с того конца, где больше заместителей, называют их и называют сам углеводород с окончанием «ан». В названии радикалов соблюдается правило старшинства.
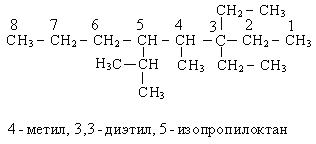
Способы получения
Основным природным источником алканов является нефть. Под термином нефть обычно понимают природный газ и собственно нефть — это совокупность углеводородов от метана СН4 до С70Н142.
Природный газ содержит 95% метана, 5% этана, пропана, бутана. Состав нефти, в зависимости от месторождения, различен и представляет собой смесь углеводородов. Первичным способом переработки нефти является ее перегонка, позволяющая выделить различные фракции.
Таблица 1
| Фракции нефти | Пределы выкипания | Состав углеводородов |
| петролейный эфир | 20° | С5 – С6 |
| легкий бензин | 61 – 100 | С6 – С7 |
| природный бензин | 40 – 200 | С5– С10 |
| керосин | 200 – 300 | С12– С18 |
| газойль | ñ 300 | высшие алканы |
| смазочные масла | ||
| битум |
При первичной перегонке выход основного продукта – бензина – составляет 20%. С целью увеличения выхода бензина отдельные высокомолекулярные фракции нефти подвергают переработке: термическому или каталитическому крекингу и пиролизу. Основные реакции при крекинге – это реакции расщепления, изомеризации и циклизации. В результате этих процессов значительно увеличивается октановое число бензина. Наиболее качественный бензин представлен разветвленными углеводородами. Для оценки качества бензина существует шкала октановых чисел.
По этой шкале за ноль принимается линейный углеводород — гептан, а за 100 — изооктан (2, 2, 4 триметил пентан). Если марка бензина АИ 95, то это значит, что данный бензин ведет себя аналогично эталонной смеси, состоящей из 95% изооктана и 5% гептана. Октановые числа могут быть повышены при добавлении тетраэтилсвинца Pb(C2H5)4. За границей в качестве добавок используют третбутилметиловый эфир:
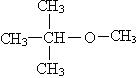
При вакуумной перегонке высокомолекулярных фракций нефти выделяют смазочные масла: подшипниковое, соляровое, вазелиновое. Фракцию С12– С15 используют как ракетное топливо.
К природным источникам углеводородов кроме нефти относятся каменный и бурый уголь, горный воск, торф.
Кроме природных источников существуют синтетические способы получения алканов:
1. Крекинг нефти (промышленный способ):
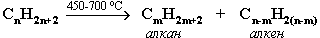
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан и др.
2. Гидpиpование непpедельных углеводоpодов:
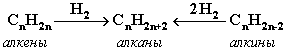
3. Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni):
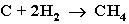
4. Из синтез-газа (СО + Н2) получают смесь алканов:
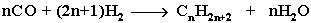
5. Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода (реакция Вюрца):
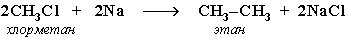
6. Из солей карбоновых кислот:
а) сплавление со щелочью (реакция Дюма):
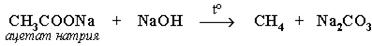
б) электролиз по Кольбе:
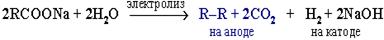
Химические свойства
Типичными реакциями предельных углеводородов являются реакции замещения, протекающие по радикально-цепному механизму (SR).
Радикалы обладают большей энергией, чем ионы, и ее достаточно для разрыва d-связи.
1. Галоидирование. Хлор реагирует с предельными углеводородами только под влиянием света и при нагревании:
CH4 + Cl2  CH3 + HCl
CH3 + HCl
Механизм реакции:
Cl2 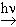 Cl • + Cl •
Cl • + Cl •
CH4 + Cl • → CH3 • + НCl
CH3 • + Cl2 → CH3Cl + Cl •
При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения атомов водорода:
CH3Cl + Cl2 → CH2Cl2 + HCl
СН3Сl + Cl2 → CH2Cl2
дихлорметан
СН2Сl2 + Cl2 → CНСl3 + НCl
хлороформ
CНСl3 + Cl2 → ССl4 + НC
тетрахлорметан
Замещение в разветвленных алканах протекает в следующей последовательности: сначала замещение проходит у третичного атома углерода, затем у вторичного, а потом у первичного:
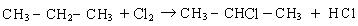
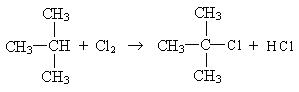
Такая последовательность протекания реакций находится в соответствии с правилом, согласно которому любая органическая реакция протекает через стадию образования наиболее устойчивого радикала или иона. Наиболее устойчивыми являются третичные радикалы, затем вторичные и первичные.
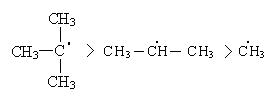
Третичный радикал более стабилен, так как имеет большую степень делокализации неспаренного электрона.
2. Сульфирование. При обычной температуре серная кислота на алканы не действует.
Однако дымящая серная кислота с высшими алканами дает сульфокислоты:
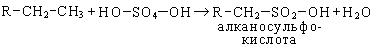
Нейтрализация продукта сульфирования дает алкилсульфонат:
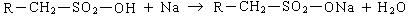
Алкилсульфонаты были первой активной основой, используемой для получения синтетических моющих средств.
Реакционная способность алканов в реакции сульфирования изменяется в следующей последовательности: атомы водорода, связанные с вторичными углеродными атомами, замещаются легче, чем связанные с первичными атомами, водороды у третичного атома углерода не замещаются.
3. Сульфохлорирование. Реакция сульфохлорирования идет на свету и в присутствии катализаторов, образующих в условиях реакции свободные радикалы:
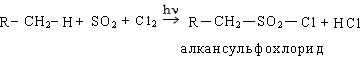
Механизм реакции:
Cl2 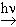 Cl • + Cl •
Cl • + Cl •
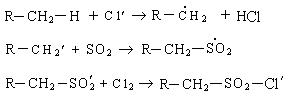
Нейтрализация алкансульфохлорида дает алкилсульфонат:
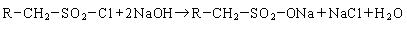
4. Окисление. Окисление высших алканов проводится кислородом воздуха в присутствии катализатора:
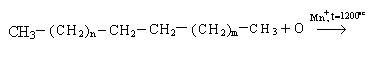
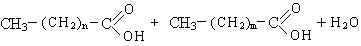
Механизм реакции:
R: R → R• + R•
R• + O2 → R•- O -O•
R•- O -O• + R H → R- O - O - H + R•
гидроперекись
Процесс окисления протекает с образованием гидроперекиси.
Распад гидроперекиси происходит с образованием кислот, спиртов и карбонильных соединений.
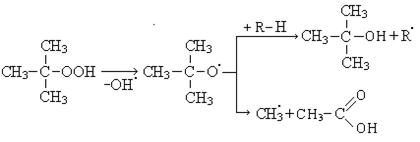
Высокомолекулярные карбоновые кислоты могут быть использованы для получения моющих средств.
5. Нитрование (реакция Коновалова). Нитрование алканов проводят разбавленной азотной кислотой при нагревании:
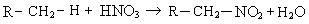
Механизм реакции:
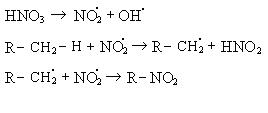
При нитровании алканов также соблюдается порядок реакционной способности С–Н-связей, характерный для реакций радикального замещения:
Стрет – Н > Свтор – Н > С пер – Н
Применение алканов
Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека:
- алканы являются базовым сырьем для различных отраслей тяжелого и легкого органического синтеза;
- газообразные алканы используют в качестве ценного топлива;
- микробиологическая переработка высокомолекулярных фракций нефти позволяет получить аминокислоты и белки;
- жидкие углеводороды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей.
 2015-03-20
2015-03-20 9592
9592








