Скорость химической реакции увеличивается с повышением температуры. Приблизительно оценить влияние температуры на скорость реакции можно по правилу Вант-Гоффа:
при повышении температуры на каждые 10 градусов скорость реакции увеличивается в 2-4 раза.
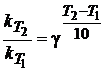
35,36.Уравнение Аррениуса. Энергетический профиль реакции; энергия активации. Понятие о теории активных соударений, образование активированного комплекса.
Уравнение Аррениуса.
 где
где
А – множитель, являющийся произведением стерического фактора  и частоты столкновений Z
и частоты столкновений Z

Энергия активации - избыточная энергия, которой должны обладать сталкивающиеся молекулы, чтобы быть способными к химической реакции
Теория активных соударений. Для того чтобы произошла химическая реакция, необходимо, чтобы частицы столкнулись. Скорость реакции пропорциональна общему числу двойных столкновений в единицу времени в единице объема
w=qzобщ, где
q – коэффициент пропорциональности;
zобщ– общее число столкновений.
 2018-01-21
2018-01-21 434
434








