Давление пара, содержащего нелетучее растворенное вещество, прямо пропорционально молярной доле растворителя. Обозначим давление насыщенного пара чистого растворителя при данной температуре через Р0, а давление насыщенного пара растворителя над раствором неэлектролита через Р, тогда разность Р0 – Р = ΔР покажет величину понижения парциального давления пара над разбавленным бинарным раствором неэлектролита. Отнеся эту разность к давлению пара растворителя, получим так называемое относительное понижение давления пара растворителя: 
 = х1
= х1
х1 - молярная доля растворителя.
Второй закон Рауля.
Второй закон Рауля: Повышение температуры кипения или понижение температуры замерзания разбавленных растворов неэлектролитов пропорциональны числу частиц растворенного вещества и не зависят от его природы. Математическое выражение:
∆Tкип =Eb
E- эбулиоскопическая константа
b- моляльность раствора
∆Tзам =Kb
K-криоскопическая константа
Приведите основные формулы для расчета молярной массы. Температура кипения и температура замерзания растворов.
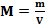 ;
;
M = Vm * p;
M = m0 * NA;
 ;
;
M = m0 *  .
.
 2018-01-21
2018-01-21 381
381








