15.1 Біосинтез основ
Пурини. Синтез мононуклеотидів відбувається у всіх організмів за загальним шляхом. Однією із стадій є синтез основ. Досліди зі сполуками, що мають ізотопну мітку дозволили отримати дані про участь різних речовин у формуванні ароматичного пуринового кільця (рис. 15.1):

Рис. 15.1 Походження атомів пуринового кільця
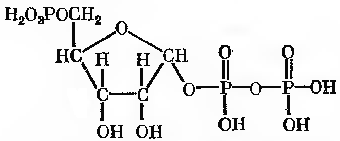
5-фосфорибозил- 1-пірофосфат

Вихідною речовиною в біосинтезі пуринів слугує 5-фосфорибозил-1-пірофосфат (ФРПФ), який приймає γ-аміногрупу глутаміна та перетворюється в 5`-фосфорибозиламін (ФРА) (рис.23-2). Реакція каталізується фосфорибозилпірофосфат-амідотрансферазой. Наступна реакція ФРА з гліцином приводить до утворення гліциномідорибонуклеотида (ГАР) – сполучення нуклеотидної природи, в якому амідна група знаходиться в положенні, яке звичайно займає пуринова або піримідинова основи. Реакція ГАР з глютаміном веде до синтезу формілгліцинамідінрибонуклеотида (форміл - ГАМ).
Після замкнення кільця утворюється імілазолмістка сполука 5- аміноімідазолрибонуклеотид (АІР). При карбоксилюванні цієї сполуки формується рибонуклеотид 5-аміноімідазол- 4- карбонової кислоти (карбокси- АІР). Потім утворюється відповідний амід, 5-аміно-4-імідазол-карбоксиамідрибонуклеотид (АІКАР). Остання сполука уявляє собою продукт двох реакцій, які протікають через утворення проміжної сполуки – 5-аміноімідазол-4-сукцинокаркарбоксамідрибонуклеотида (сукцино- АІКАР). Завершується побудова пуринового кільця в реакції з N- формілтетрагідрофолівою кислотою, формільна група якої приєднується до 5-аміногрупи імідазолкарбоксамід-рибонуклеотида. Утворений рибонуклеотид уявляє собою інозинову кислоту (інозит-5`-монофосфат, ІМФ), та є попередником усіх інших пуринових нуклеотидів.
Амінування ІМФ у АМФ відбувається у дві стадії з утворенням у якості проміжного сполучення аденілоянтарної кислоти (аденілсукцината) (рис.23-3). Утворення ГМФ з ІМФ також є двостадійною реакцією, в ході якої спочатку утворюється ксантозін-5`-монофосфат (КМФ), потім відбувається його амінування та утворення ГМФ (рис.23-4). Обидва пуринових нуклеотиди, АМФ та ГМФ, фосфорилюються кіназами, проходять стадію

Рис. 23-3. Реакція утворення аденілової кислоти з інозинової
утворення дифосфатів та перетворюються в АТФ та ГТФ:
АТФ+АМФ=АДФ+АДФ
аденілаткіназа
АТФ+ГМФ+АДФ+ГДФ
гуанілаткіназа
АТФ+НДФ=АДФ+НТФ
нуклеозиддифосфаткіназа
Фосфорилювання пуринових мононуклеозидфосфатов
Піримідини. Вихідними речовинами, які приймають участь в синтезі піримідинових нуклеотидів, слугують аспарагінова кислота та карбамоїлфосфат, які під дією аспартат-карбамоїлтрансферази перетворюються в карбамоїласпартат (рис. 23-5).Після замикання піримідинове кільце підлягає дії дигидрооротази, в результаті утворюється дигідроортова кислота. В НАД-залежній реакції відбувається відщепленя двох атомів водню, при цьому формується молекула оротової кислоти. Вслід за цим в реакцію вступає 5-фосфорибозил-1-пірофосфат (ФРФФ), яка є, як було відмічено вище, важливим проміжним метаболітом в синтезі нуклеотидів. Відбувається пірофосфорилазна реакція, в ході якої до ортової кислоти приєднається рибозо-5-фосфат, що присутній в сфері реакції як структурний компонент ФРФФ. В результаті утворюється оротидин-5`- моно фосфат (ОМФ) та вивільняється неорганічний пірофосфат.

Рис. 23-4. Утворення ксантозин- та гуанозинфосфатів
Декарбоксилювання оротидин-5`-монофосфата призводить до утворення уридин-5`-монофосфата призводить до утворення уродин-5`-монофосфата (УМФ), попередника інших піримідинових нуклеотидів. У подальшому в присутності кіназ УМФ перетворюється спочатку в уродин-5`-дифосфат (УДФ), а зтем в уродин-5`- три фосфат (УТФ). Перетворення урацилу в цитозин відбувається на рівні нуклеозидтрифосфатів та здійснюється під дією ЦТФ-синтетази:
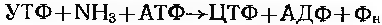

Рис.23-5. Схема біосинтезу піримідинів
2. Мікробіологічний синтез нуклеозидфосфатів
Мікробіологічний синтез нуклеотидів та їх похідних входить у життя в силу необхідності мати ці специфічні сполучення у повсякденній практичній діяльності. Перші кроки були пов’язані з необхідністю мати природні сполучення, що придають смак та аромат харчовим продуктам. До сих пір однією з перспективних сфер їх застосування розглядається штучна їжа. Нуклеотиди та їх похідні можуть застосовуватися як лікувальні препарати, заповнюючи недолік у них того або іншого організму, особливо у якості кофакторів або коферментів. Широко використовуються вони в лабораторній біохімічній практиці.
Мікробіологічний синтез нуклеотидів відрізняється від багатьох класичних ферментаціонних процесів необхідністю вносити в середовище метаболічні попередники синтезуючих продуктів. У ряді процесів мікробні клітини виконують функції носіїв певних ферментних активностей, забезпечуючи синтез. Тут процеси росту клітин та синтезу продукта роз’єднані. Поряд з мікробіологічним синтезом нуклеотидів в їх різних похідних видове місце можуть займати ферментативні перетворення одних нуклеотидів в інші, а також ензиматичне розщеплення нуклеїнових кислот з наступним фракціонуванням отриманих продуктів гідролізу.
Аденозинтрифосфорна кислота. (АТФ). Отримання аденозиндифофата та аденозинтрифосфатаз засноване на здійснені культурою мікроорганізма реакції фосфорилювання аденіну або аденілової кислоти (5`-АМФ).
Культура Brevibacterium ammoniagenes АТСС 6872, що використовується, росте на середовищі, яке містить глюкозу високої концентрації, сечовину, дріжджовий екстракт, солі фосфору, магнію, кальцію та біотин. По ходу культивування вносять аденозин, який підлягає ензиматичному фосфорилюванню з утворенням аденилової кислоти, АТФ та АДФ. В аналогічних умовах культивування, але при внесенні гуанозину можна отримати гуанілову кислоту, ГДФ та ГТФ. Фосфорилюючим агентом виступає в сполучених реакціях АТФ. Накопичити її в сфері реакції без передачі на акцепторну молекулу внесеного ззовні аденозину не вдається.
Іншим мікробним джерелом ферментативних систем, що здійснюють фосфорилювання 5`-АМФ, можуть слугувати хлібопекарські дріжджі, взяті у вигляді гомогената або ацетонового порошку. Реакційна суміш містить 5`-АМФ, глюкозу, фосфатный буфер (рН 7,0) та дріжджі, підготовлені, як було сказано вище. Реакція протікає доволі швидко, без струшування, при 37С (рис.23-6). Вслід за виснаженням глюкози, при мінімальній кількості неорганічного фосфору відмічається максимум вмісту АТФ. За досягнення максимума АТФ спостерігається його розпад по АДФ та АМФ при одночасному підвищення рівня неорганічного фосфору. На вихід продукту суттєвий вплив оказує концентрація фосфата, що присутній у вигляді фосфатного буфера. Відхилення від якоїсь оптимальної величини може привести до ряду небажаної реакції на молекуле субстрату та викликати утворення інозинової кислоти та гіпоксантину.
Запропонована наступна схема фосфорилювання АМФ:

В процесі гліколіза має місце фосфорилювання АДФ в АТФ. Одночасно може відбуватися ряд інших реакцій.
Зокрема, під дією нуклеотидази аденилова кислота може розкладатися до аденозину та неорганічного фосфату. Аденозин, в свою чергу, завдяки активності аденозинкінази підлягає фосфорилюванню з утворенням АМФ та АДФ. Внаслідок відзначених вище взаємних переходів важко довести послідовність цих реакцій.
Імовірно, внесена ззовні аденілова кислота потрібна для виконання «затравочної» реакції. Очевидна необхідність мати в сфері реакції високу концентрацію глюкози та збалансована кількість фосфату. В аналогічних умовах фосфорилюються ГМФ, ЦМФ та УМФ.

Тривалість інкубації
Рис. 23-6. Фосфорилювання 5`-АМФ зруйнованими
клітинами хлібопекарських дріжджів
По дещо іншому шляхові відбувається синтез АТФ, коли в середовище для культивування вводять аденін. В цьому випадку ключовою реакцією повинна бути N-рибозидація аденіну. Процес звичайно проводять як типову аеробнк ферментацію з додаванням попередника. Продуцентами можуть слугувати Brevibacterium ammoniagenes та Corynebacyerium sp. Тут також необхідно мати середовище з глюкозою високої концентрації. На першому етапі синтезу відбувається утворення АМФ за рахунок внесеного в кінці експоненціальної фази фази росту культури аденіну та синтезованого клітиною 5`-фосфорибозил- 1`-пірофосфату (ФРФФ, 5-фосфо-α-D-рибозо-1-дифосфат). Реакцію здійснює аденінфосфорибозилтрансфераза:
ФРФФ+аденін=АМФ+ФФн
Подальший процес відбувається так же, як показано вище для АМФ. В результаті реакції, що відбувається між рибозо-5-фофатом (Р-5-Ф) та АТФ в клітинах утворюється ФРФФ. Реакція відбувається при АТФ: D-рибозо5-фофат пірофосфаттрансферази. АТФ та Р-5-Ф утворюються в результаті катаболізма глюкози. Р-5-Ф – в ході функціонування ГМФ-шляху, а АТФ – як продукту гліколізу. (рис. 23-7).
Тут же може мати місце надсинтез відповідних нуклеозидфосфатів із відмінних від аденіну основ: гуаніну, гіпоксантину, ксантину, урацилу, 6-меркаптопурину, 8-азагуанину, 4-тіоурацилу.
В останні роки викликає інтерес синтезу АТФ або його регенерація за участі іммобілізованих ферментів, які виділені із мікроорганізмів, або імобілізованих мікробних клітин. Одна з ферментних систем, карбамілфосфокіназа, була виділена з культури Streptomyces faecalis та іммобілізована на алкіл амінному пористому склі за присутності глутарового альдегіду. Для регенерації АТФ із АДФ розчин останньої на фосфатному буфері (рН 5,5) за присутності солі магнію пропускали через колонку.
В іншій системі синтезу АТФ з АМФ клітини Saccharomyces cervisiae були іммобілізовані шляхом їх механічного включення в поліакриламід ний гель або мікрокапсулюванням в етилцелюлозу. При мікрокапсулюванні вдається іммобілізувати на одиницю об’єму в 5-6 разів більше клітин та зберігати в 4-5 раз більш високу ферментативну активність. При безперервному отриманні АИФ з АМФ активність препарату хоча і знижувалася з часом, але складала більш 50% від вихідної через 10 днів.
Інозинова кислота. Відомі два шляхи мікробіологічного синтезу іозинової кислоти, один з них – з використанням метаболічного попередника, нуклеозида. При іншому методі необхідно мати ауксотрофний мутант, оскільки відомо, що інозинова кислота уявляє собою метаболічний попередник важливих пуринових нуклеотидів – аденілової та гуанілової кислот.

Рис. 23-7. Схема реакції синтеза АТФ з аденілу
АТФ1-молекули з’єднання, що йдуть на процес пірофосфорилювання Р-5-Ф, аденілаткіназну реакцію та інші можливі реакції, АТФ2- молекули з’єднання, що накопичуються в середовищі в результаті над синтезу: Е1- АТФ. D-рибозо-5-фосфат пірофосфотрансфераза, Е2 – аденін фосфорибозилтрансфераза. Е3- аденілаткіназа, ЕГП – ферменти гліколітичного та пентозофосфатного шляхів.
При здійсненні першого з названих способів в сферу реакції вводять нуклеозид – інозит та джерело ферменту, фосфорилюючий інозит в 5`-положенні рибозного залишку. Джерелами фосфорилюючого ферменту - нуклеозиддифасфаттрансферази можуть слугувати багато мікроорганізмів, шо відносяться до родів Flavobacterium, Serratia, Staphilococcus, Pseudomonas. Донорами фосфору в цій реакції можуть бути нуклеотиди, а також неприродні з’єднання: н -нітрофенілфосфат (н -НФФ), бензилфосфат, фенілфосфат. У нашій крані в якості джерела фосфорилюючого ферменту запропонований один із штамів Pseudomonas trifolі. Культуру попередньо вирощують на середовищі, що містить глюкозу, пептон, дріжджовий екстракт. В якості ферментного препарату, що здійснює реакцію, використовують живі клітини, клітини, які висушені під вакуумом або ацетоном, а також заморожені клітини, оскільки локалізація ферменту внутрішньоклітинна. З названих вище донарів фосфату кращим враховується п-нітрофенілфосфат. Реакція відбувається ацетатном буфері при рН 4,0 за присутності іонів міді та цинку, помітно збільшуючий вихід готового продукту.
Найбільш важливими факторами, що визначають активність реакції фосфорилювання інозину, є концентрація донора фосфата, акцептора (інозину) кількості клітин використаної культури. При оптимальних співвідношеннях п-НФФ та інозиту клітини Ps. trifolі можуть фосфорилювати до 90 % інозиту в реакційній суміші. Вихіінозинової кислоти може бути підвищений, якщо до реакційної суміші додати ПАР, зокрема різноманітні твіни. Їх концентрації повинні бути підібрані дослідним шляхом.
Як і у всіх інших випадках, коли в якості ензиматичних препаратів використовують клітини мікроорганізмів, виникає необхідність оцінити активність ферментів при деградації цільових продуктів синтезу. В даному небажані для інозинової кислоти активні фосфомоностераза та 5`-нуклеотидаза. Якщо неможливо подавити їхню активність інгібіторами, то потрібно вибирати умови, при яких вона буде найменшою. В першу чергу до таких умов, найбільш легко регулюючим, відноситься температура та РН середовища, де відбувається реакція.
Інозинову кислоту виділяють у вигляді солі барію та шляхом іонообмінної хроматографії. Як було сказано вище, одним із способів отримання інозинової кислоти є її синтез мутантними штамами з певними генетичними порушеннями регуляторних механізмів, що веде до над синтезу продукту. В якості продуцентів застосовують аденілові ауксотрофи Brevibacterium ammoniagenes. Для них є характерною низька величина нуклеотиддеградуючої активності. Однією з найважливіших особливостей таких культур повинна бути добра проникливість клітин для викиду в навколишнє середовище ряду внутрішньоклітинних метаболітів. За уявленнями, інозинова кислота, що синтезується в клітинах, розкладається в них, утворюючи основу – гіпоксантин, який потім виходе з клітини. Ресинтез інозинової кислоти відбувається поза клітиною. Для його здійснення треба мати рибозо-5- фосфат та АТФ. Синтез інозинової кислоти відбувається в даному випадку згідно механізму, який описаний вище для АМФ, через утворення ФРФФ. Реакцію здійснює гіпоксантинфосфорибозилтрансфераза:

Одна з умов порушення клітинної проникності для більшості відомих продуцентів інозинової кислоти є нестача марганцю в середовищі. Чутливість таких штамів до іонів марганцю робить неможливим їх використання в промислових умовах, так як сировина для середовищ звичайно містить знаяну кількість іонів двухвалентних металів, зокрема марганцю. У СРСР в ВНІІгенетика отриманий мутант, стійкий до іонів марганцю. Для заповнення дефіциту аденіну не виникає необхідності вводити його в середовище для культивування. Використання кукурузного екстракту у якості одного з компонентів середовища заповнює потребу штаму в аденіні. Останній контролює синтез інозинової кислоти за типом негативного зворотнього зв’язку на одному з початкових етапів біосинтезу пуринових основ. Абсолютна величина концентрації аденіну для оптимального ходу процесу залежить від ряду факторів: температури, рівня аерації, вмісту неорганічного фосфату, наявності гістидину та ін.
Крім мікробіологічного (ферментативного) синтезу інозинової та гуанілової кислот можлива комбінація мікробіологічного та хімічного синтезу. При використанні дефіцитного по аденіну мутанту Bacillus subtilis в середовищі накопичується інозит, а у випадку пурин-дефіцитного мутанту Bac. megaterium – 5`-фосфорибозил – 5-аміно-4-імідазол-карбоксамід (АІКАР). Подальші етапи здійснюються шляхом хімічних перетворень:
1) інозин→2`-3`-О-ізопропілдієнінозин→2`-3`-О-ізопропілдієнінозин 5`-фосфордихлорид→5`-ІМФ;
2) АІКАР→2-меркаптоінозин→гуанозин→5`-ГМФ.
Нікатинамідаденіндинуклеотид (НАД). Мікробіологічний синтез відбувається шляхом культивування продуценту Brevibacterium ammoniagenes з попередником. Вирощування продуценту рекомендують проводити на середовищах, що містять глюкозу, сечовину, дріжджовий екстракт, фосфати, солі магнію, кальцію та біотин. Попередниками НАД в середовищі можуть бути нікотинова кислота або нікотинамід, а також аденін. Попередниках в умовах дослідження звичайно вводять на другу добу росту культури (рис.23-8). При цьому на п’яту добу в середовищі накопичується з перевагою НАД, а також АМФ, АДФ та АТФ.

Час, доба
Рис.23-8. Динаміка накопичення НАД при
культивуванні Brevibacterium ammoniagenes.
1-біомаса, 2-НАД, 3-рН середовища
В цей час культура вступає в фазу стаціонарного росту. Крім вказаних речовин в середовищі міститься проміжний продукт синтезу НАД-нуклеотид нікотинової кислоти. Безпосередньо в синтез включається нікотинова кислота, тому, якщо в середовищі вводять її амід, відбувається ферментативне дезамінування з утворенням кислоти. На рис.23-9. подано схему синтезу, де фосфорибозилпірофосфат позначений ФРФФ, а залишки фосфорної кислоти в нуклеотидах - Ф. На цій схемі показана ще одна реакція, в результаті якої утворюється фосфорильоване похідне НАД – нікотинамідаденіндинуклеотидфосфат. Реакцію здійснює НАД-кіназа, що передає фосфорний залишок від АТФ на НАД. Для отримання НАДФ запропонована також система, в якій в якості ферментного препарату використовується безклітинний екстракт Rroteus mirabilis, а фосфорилюючим агентом виступає п -нітрофеніл.

Рис. 23-9. Схема біогенезу НАД+ та НАДФ+ з нікотинової кислоти у якості метаболічного попередника
У СРСР розроблений синтез НАД в культурі хлібопекарських дріжджів. Дріжджові клітини використовують фактично як мікрореактори для синтезу НАД з попередників за присутності джерела енергії. Система складається із суспензії дріжджових клітин (50%) у розчині, що містить фосфати, солі магнію, аденін та нікотинамід в якості попередників, а також глюкозу і екстракти хлібопекарських дріжджів або кормових дріжджів. При цьому в порівнянні з вихідною кількістю НАД збільшується в 10 разів. Потім відбувається екстракція НАД з клітин та виділення його шляхом іонообмінної хроматографії.
Фосфорильоване похідне – НАДФ отримують, як було сказано вище, за рахунок НАД-кіназної реакції. Джерелом ферменту можуть слугувати іммобілізовані в поліакриламідному гелі клітини мікробної культури Achromobacter aceris. Іммобілізовані та вільні клітини утворюють максимальну кількість НАДФ при рН 7,0 та температурі 45С. Однак іммобілізовані клітини на відміну від вільних повільніше втрачають активність в лужному середовищі та при підвищених температурах. Колонка з імобілізованими клітинами втрачає 50% активності після 20 діб роботи, а вільні клітини – вже через 6 годин.
Гуанозинполіфосфат. В останні роки серед продуктів обміну мікроорганізмів речовин нуклеотидної природи знайдені гуанозинполіфосфати. Переважно це тетра- або пентафосфати. Вони виконують функції регуляторів в багато чисельних біохімічних реакціях, тому можливість препаративного отримання цих речовин заслуговує уваги.
Накопичення гуанозинполіфосфатів знайдено у культурі Brevibacterium ammoniagenes, коли в реакційній суміші були присутні гуанозин-5`-монофосфатабо ксантозин-5`-монофосфат. Штам уявляє собою мутант, що потребує для свого вирощування присутності в середовищі дорогих для промислового виробництва компонентів таких, як дріжджовий екстракт, біотин, тіамін, пантотенова кислота та ін.
Ксантинін-5`-монофосфат є метаболічним попередником гуанілової кислоти, яка утворюється після амідування пуринової основи глютаміном за присутності АТФ (див. рис. 23-4).
Процес ензиматичного перетворення метаболічних попередників (Г-5`-Ф або Кс-5`-Ф) в нуклеозидполіфосфат відбувається в середовищі, що містить глюкозу, а також високий рівень фосфатів та магнію. Окрім полі фосфатів в середовищі накопичується 5`-ГМФ, 5`-ГДФ, 5`-ГТФ, однак гуанозинполіфосфати утворюються в більш вузькому інтервалі рН та при іншому температурному оптимумі:
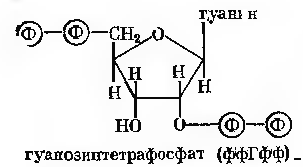
Фермент АТФ нуклеотид пірофосфаттрансфераза, який здійснює перенесеня пірофосфатних залишків з АТФ на акцепторні молекули, був виділений з Streptomyces adephospholyticus. Продуктами реакції тут можуть бути нуклеозин-3`-дифосфат-5`-моно (ди- та три-) фосфати, такі, як фффГфф, ффГфф, фГфф, а також похідні аденіну та інозиту фффАфф, фффІфф.
3 БІОСИНТЕЗ ФЛАВІНІВ
До числа найважливіших флавінових сполук, що синтезуються мікроорганізмами, відносяться рибофлавін та флавінові: кофермент фланінмононуклеотид (ФМН) та флавінаденіндинуклеотид (ФАД). Деякі бактерії, дріжджі та дріжджоподібні гриби здатні утворювати дуже великі кількості флавінів, що дає можливість використовувати їх для промислового отримання препаратів В2.
Метаболічним попередником рибофлавіну є гуанозинтрифосфат, який під дією циклогідролазы ІІ перетворюється в похідну перемідину І (рис.23-10). Рибітильний боковий ланцюг рибофлавіну походе з рибозильного залишку гуанозинтрифосфата. Потім проміжний продукт І перетворюється через стадію ІІ у 4-рибітоламін 5-аміноурацил. Останній конденсується з С4-похідним, діацетилом, з утворенням 6,7-диметил-8-рибітиллумазину.
6,7-диметил-8-рибітиллумазин перетворюється під дієюрибофлавінсинтетази в рибофлавін. Для утворення однієї молекули рибофлавіну необхідні дві молекули 6,7-диметил-8-рибітиллумазину. В даній реакції 6-й та 7-й вуглецеві атоми разом з приєднаними до них метальними групами одной молекули переноситься на іншу молекулу 6,7-диметил-8-рибітиллумазину з утворенням 4-рибітиламін-5-аміноурвцилу та рибофлавіну.
Рибофлавін може взаємодіяти з високоенергетичними фосфатами переважно з АТФ, з утворенням рибофлавін-5`-фосфату (ФМН). При взаємодії ФМН з АТФ утворюється флавінаденіндинуклеотид (ФАД). Регуляція синтезу рибофлавін у здійснюється за принципом негативної зворотнього зв’язку, а також за рахунок зміни концентрації солей заліза в середовищі.
 2018-01-21
2018-01-21 1821
1821
