Багато ферментів є двокомпонентними, тобто складаються з білка та зв’язаного з ним кофермента (коензим) – термостабільної органічної сполуки небілкової природи. Білкова частина двокомпонентного ферменту називається апоферментом. В результаті ферментних реакцій коферменти, як правило, не підлягають зміненням та цим відрізняються від субстрату. Оскільки коензими виконують свої функції в визначених типах біохімічних реакцій, роздивимося їх у тому порядку, в якому класифікують ферменти.
1. Оксиредуктази
До цього класу належать всі ферменти, шо каналізують окисно-відновні реакції. Субстрат, який підлягає окисненню, розглядається як донор водню або електронів.
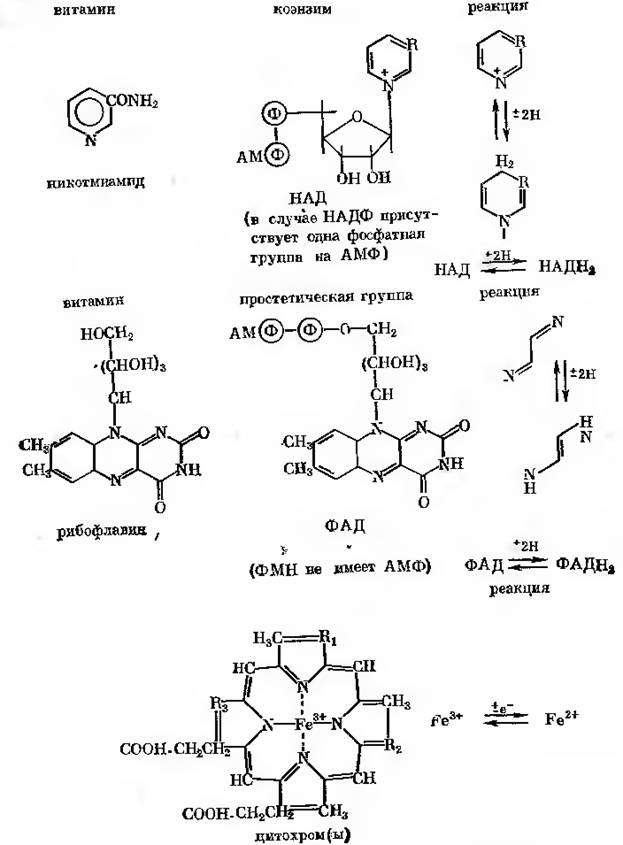
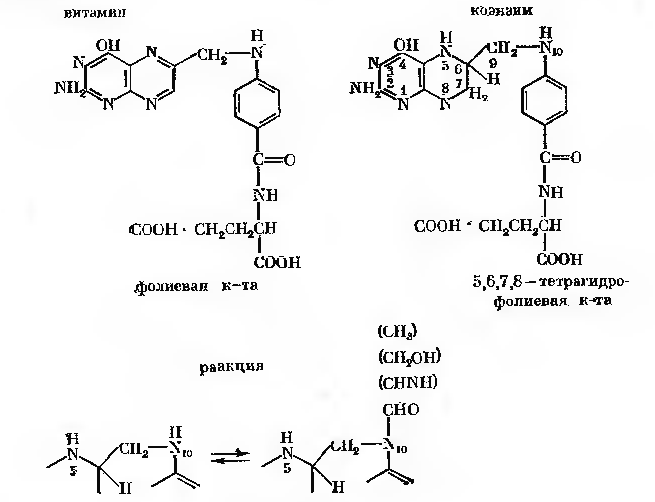
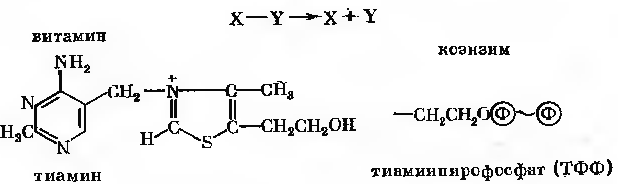
У якості безпосередніх переносників виступають никотинамідаденіндинуклеотид (НАД) або його фосфорильоване похідне (НАДФ), флавінмононуклеотид (ФМН) або флавінаденіндинуклеотид (ФАД), а також цитохроми, що містять простетичну групу, в яку входить іон заліза, металу з перемінною валентністю. В середовища для культивування мікроорганізмів інколи вводять вітаміни. В організмах вітаміни можуть перетворюватися в коензими за рахунок специфічних реакцій, наприклад, аденілірування, тому на ряду з коензимами тут показаний відповідний вітамін.
Цитохром уявляє собою гемо протеїд, характерна функція якого складається в переносі відновлених еквівалентів, зв’язаним зі зворотною зміною рівнів окиснення простатичної групи. Усі відомі типи цитохромів у відповідності з їх структурою розділені на 4 групи.
Роль цитохрому складається в тому, що його окиснена форма забирає електрон водневого атому, який віднятий дегідрогеназою від окислюючого субстрату. В результаті цього водневі атоми перетворюються в іони водороду, а цитохром з окисненої форми переходе у відновлену, при чому залізо, що міститься у ньому, перетворюється з трьохвалентного у двовалентне.
У подальшому віднятий від водневого атому електрон через систему переносників електронів передається атому кисню; при цьому останній здобуває здатність реагувати з іонізуючими водними атомами, утворюючи воду:
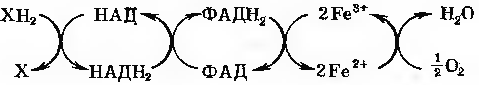
Утворений в ході реакції кисень в подальшому приймає участь в реакції окисного фосфорилювання, який поставляє організму енергію у вигляді АТФ:
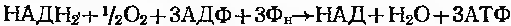
Приклади дегідрогеназ.
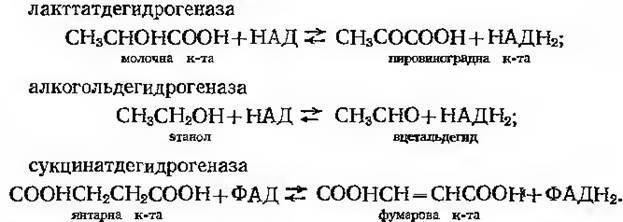
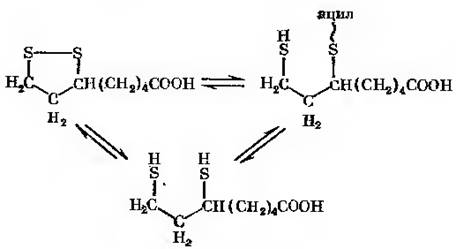
До числа коензімів, що приймають участь в метаболізмі ферментів, які відносяться до першого класу, належать ліпоєва кислота, що здатна виступати як переносник ацильних груп. Її дисульфід ний зв’язок легко розривається з утворенням двох сульфгідрильних груп. Завдяки цьому відбувається окиснення та відновлення ліпоєвої кислоти, на чому й основана її кофермент на функція:
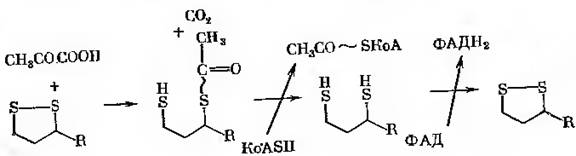
Ліпоєва кислота приймає участь в піруватдегідрогеназній реакції:
Піруват+окиснений ліпоат- S6-ацетилгідроліпоат+СО2
2. Трансферази
Трансферази - ферменти, які переносять ту або іншу групу від однієї сполуки до іншої, яка розглядається як акцептор. У багатьох випадках донором є кофактор, який приєднує групу, що належить переносу.
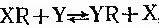
Де R-ацил-аміно-, форміл-, метил-, глікозил або фосфат.
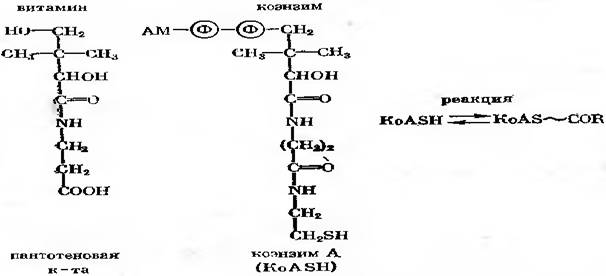
Прикладом руху трансферази може слугувати реакція, що здійснюється фосфотрансферазою
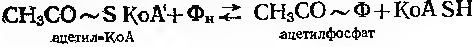
Піридоксальфосфат є коензимом в різних реакціях метаболізма амінокислот, також приймає участь в реакціях транс амінування:
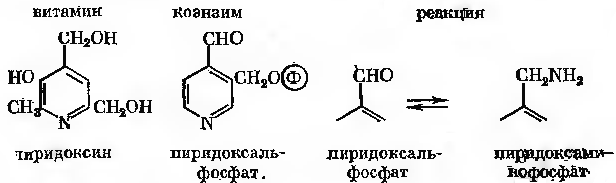
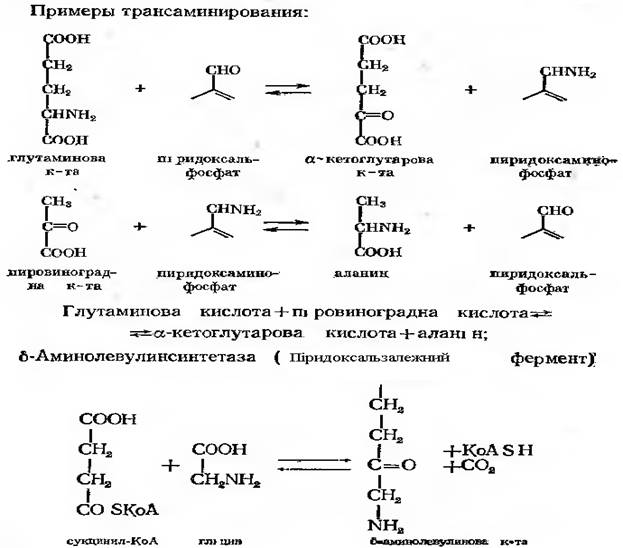
Приклади трансамінування:
В перенесенні одно вуглецевих фрагментів (форміл-, формаліно-,оксиметил- та метальних груп) приймає участь 5,6,7,8- тетрагідрофолієва кислота (ТГФ). Вона входить в якості коензиму в різні трансформі лази, оксиметилтрансферази, метилтрансферази. Найбільш важливим джерелом одно вуглецевих одиниць слугує серин. В присутності ГТФ ця амінокислота може бути розчеплена серин-оксиметилтрансферазою з утворенням гліцину та N5,N10метілен-ТГФ. При гідролізі останньої сполуки утворюється ГТФ та
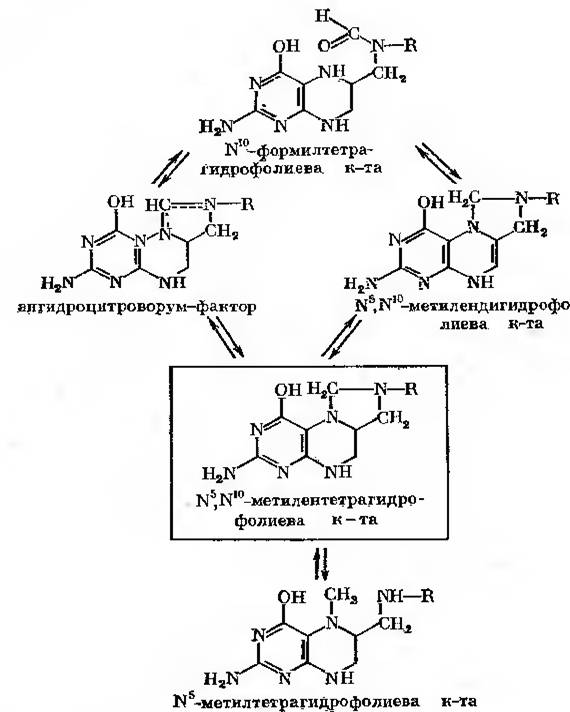
Рис. 25-1. Ензиматичне перетворення N5,N10метілентетрагідрофолієвої к-ти
Формальдегід. В результаті окиснення N5,N10метілен-ТГФ може бути перетворений у N10-форміл-ТГФ («активована мурашина кислота»), а в результаті відновлення – у N5-метил-ТГФ («активований метанол») (рис. 25-1):
Приклад переносу 1-С-фрагмента:
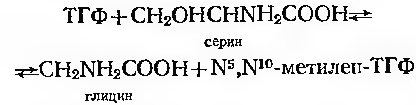
До цього ж класу трансфераз відносяться кінази, які переносять фосфатну групу від нуклеозид ди- або три фосфатів до акцептору. Однак спеціальних коензімів для цієї реакції не описано.
Приклад дії гексокінази:
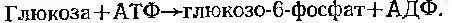
3. Гідролази
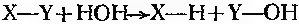
На відміну від усіх інших класів ферментів гідролази не потребують в коензимах.
4. Ліази
Ліази-ферменти, які розривають С-С, С-О, С-N та інші зв’язки в реакціях, які не являються гідролітичними або окислювальними. Ці ферменти відрізняються від інших тим, що в каталізуючих ними реакціях в одному напрямлені приймають участь два субстрати, а в зворотньому- тільки один. При дії на один субстрат від нього відщеплюється молекула з утворенням ненасиченого залишку. До числа ферментів, що відносяться до ліаз, приналежать декарбоксилази, дезамінази, альдолази та кетолази.
Реакція
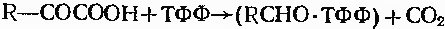
Деякі декарбоксилази та транскетолази використовують тіамінпірофосфат в якості коензиму.
Приклад дії карбоксилази:
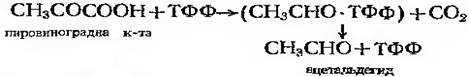
Транскетолаза:
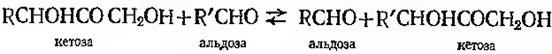
Деякі дезамінази використовують в якості коензиму піридоксальфосфат.
Приклади дії сериндегідратази:
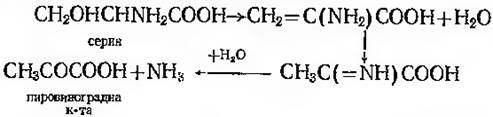
Цистеїндесульфураза:
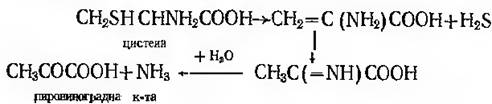
5. І зомерази
Ізомерази каналізують перетворення, які відбуваються в межі однієї молекули:
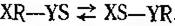
До їх числа відносяться рацемази та епімерази, наприклад аланінрацемаза:
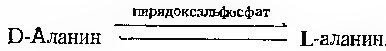
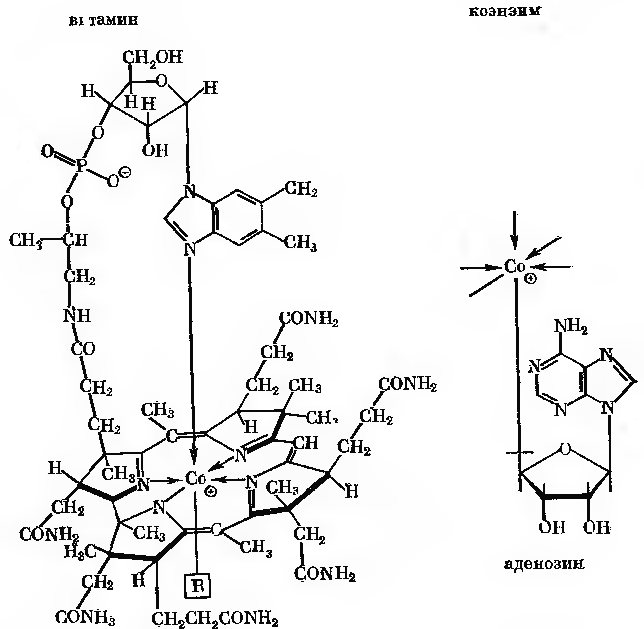
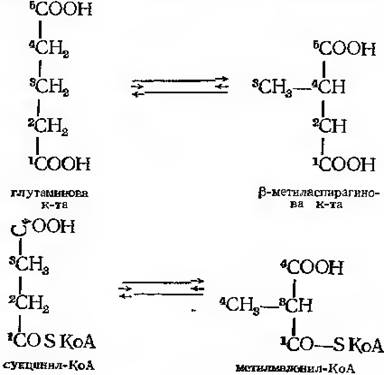
Присутність кобамідного коферменту потребує деякі мутази, наприклад метиласпартатмутаза або метитмалоніл-КоА мутаза:
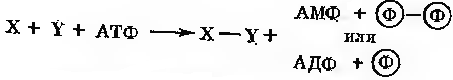
Можливий механізм
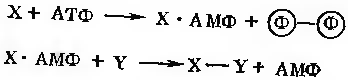
Пиклади дії ізомераз, в яких приймає участь коензим В12:
6. Лігази (синтетази)
Лігази представляють собою ферменти, які каналізують сполуки двох молекул, сполучене з гідролізом пірофосфатного зв’язку в молекулі АТФ або аналогічного три фосфату. Утворені при цьому зв’язки часто є високоенергетичними:
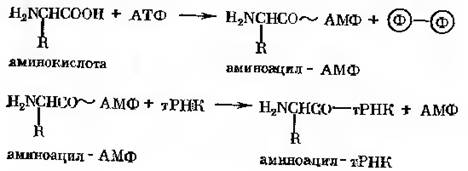
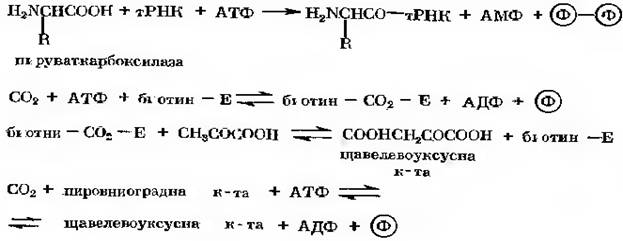
Приклад дії ферментів, активуючих амінокислоти:
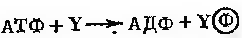
У даному випадку фермент має біотин в якості простатичної групи. Карбоксильна група біотину має зв’язок з 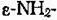 групою залишку лізину в молекулі ферменту.
групою залишку лізину в молекулі ферменту.
 2018-01-21
2018-01-21 673
673








