Возникновение, сырье и разновидности промышленного органического синтеза. Синтезы на основе оксида углерода (II), алканов и алкенов, ацетилена, нафтенов и ароматических углеводородов. Типовые химико-технологические процессы, применяемые в органическом синтезе: гидрирование, дегидрирование, окисление, восстановление, гидратация, гидролиз, алкилирование, сульфирование, хлорирование, нитрование и др. Производство и переработка ацетилена; уксусной кислоты и уксусного ангидрида; производство метанола и этанола; капролактама; стирола; акрилонитрила и метакрилата из пропилена; производство высших жирных спиртов и кислот окислением парафина.
Промышленность органического синтеза каждым годом увеличивает выпуск и ассортимент химических продуктов. Среди них можно указать разнообразные мономеры и на их основе синтетические смолы, каучуки, волокна, пластмассы, клеи, красители и большое количество различных лакокрасочных и смазочных материалов, растворителей, поверхностноактивных веществ, ядохимикатов, флотореагентов, антитфризов и антидетонаторов, взрывчатых и лекарственных препаратов, фотореактивов, душистых соединений и т.п.
1. СЫРЬЕ ПРОМЫШЛЕННОСТИ ОРГАНИЧЕСКОГО СИНТЕЗА
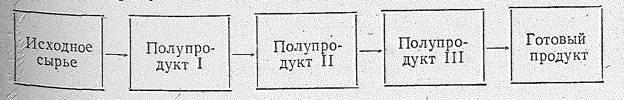
В синтезах сложных органических соединений различают исходные вещества; промежуточные продукты (полупродукты) и готовый продукт.
Исходные вещества — простые углеводороды: метан, этилен. пропилен, бутилен, ацетилен, бензол толуол и др., являются основным сырьем органического синтеза, получаются при химической переработке газообразных, жидких и твердых видов топлива. Раньше основным источником сырья органического синтеза была смола коксования и полукоксования. Широко использовалось сырье растительного и животного происхождения. В последние годы преобладающее значение приобрели жидкие углеводороды нефти, природный и попутные газы, а также газы нефтепереработки.
В настоящее время многие из перечисленных исходных веществ выпускаются десятками и сотнями тысяч тонн.
Полупродукты: окись этилена, ацетальдегид, фенол, нитробензол и другие — образуются в результате предварительной химической переработки исходных веществ и в свою очередь могут служить сырьем для получения более сложных органических веществ (пластмасс, волокон, красителей, лекарственных препаратов, физиологически активных веществ и д.р.). Связь исходного сырья готовым продуктом можно представить схемой
Например, продукт нефтехимической и коксо-бензольной промышленности бензол служит хорошим растворителем жиров, смол, каучука, серы и других соединений. В то же время он представляет собой исходное сырье для получения нитробензола, анилина, хлорбензола, фенола, этилбензола, изопропилбензола стирола, ДДТ, малеинового ангидрида, фенилэтилового спирта, моносульфокислоты и других химических продуктов и полупродуктов, используемых для изготовления красителей синтетического каучука, пластмасс, лаков, инсектицидов, фармацевтических и дезинфицирующих препаратов, взрывчатых веществ и др.
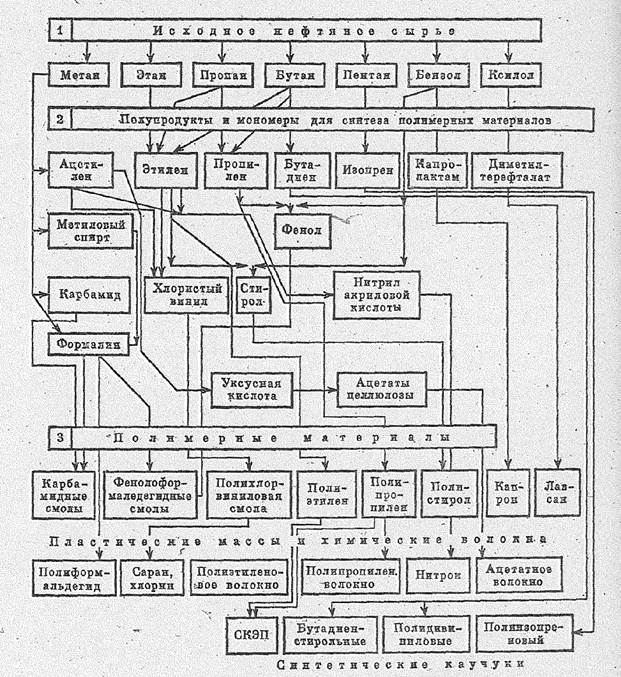
Рис. 14.1. Использование нефтяного сырья
Из продукта окисления этилена окиси этилена - получают этаноламины, этиленгликодь, ди- и полиэтиленгликоли, уксусный альдегид, диоксан, этиленхлоргидрин, стирол, этиленциангидрин и на их основе - синтетические смолы, каучуки, пластмассы, лаки, волокна, моющие средства, антифриз и другие промышленные продукты.
В настоящее время промышленность органического синтеза пользует следующие основные виды сырья: природные и попутные газы; газообразные и жидкие углеводороды получаемые при перегонке нефти, крекинге и пиролизе нефтепродуктов, твердые парафиновые углеводороды и тяжелые нефтяные остатки; коксовый и сланцевый газы; смолу коксования, а также сланцевую и древесную смолы и торфяной деготь.
Кроме того, в органической технологии в больших количествах используются и неорганические соединения: кислоты, щелочи, сода, хлор и т.п., без которых невозможно осуществление многих процессов. Как правило, любое сырье необходимо предварительно очистить от влаги, механических примесей, сернистых соединений и других примесей и разделить, выделив индивидуальные углеводороды. Так получают очищенное сырье, из которого дальнейшей переработкой можно получить те или иные полупродукты и чистые продукты.
Для выделения газообразных углеводородов применяют методы: сжатие (компрессия) с охлаждением, абсорбционно-десорбционный и адсорбционно-десорбционный. Жидкости чаще всего разделяют перегонкой и ректификацией. Очень часто в промышленности практикуется комбинирование двух или более перечисленных методов. Используя разнообразные методы разделения исходных материалов, а также наиболее современные процессы их переработки, получают важнейшие соединения, являющиеся непосредственным сырьем органического синтеза: синтез-газ (смесь СО и Н2); насыщенные алифатические углеводороды (от метана до пентанов); индивидуальные моноолефины (от С2 и выше) и их смеси; диолефины - бутадиен, изопрен и др.) ацетилен; ароматические углеводороды - бензол, толуол, ксилолы и пр.
2. ПРОЦЕССЫ ОРГАНИЧЕСКОГО СИНТЕЗА
Способы переработки любого вида сырья определяются характером продуктов, которые предполагается получить, а также составом и свойствами исходных углеводородов. Для производства продуктов органического синтеза используются типичные реакции органической химии: галогенирование, сульфирование, окисление и восстановление, гидрирование и дегидрирование, гидратация и дегидратация, нитрование, алкилирование, циклизация, изомеризация, конденсация, полимеризация, этерификация и т. п. Промышленность органического синтеза базируется в основном на реакциях синтеза т. е. получение сложных веществ из простых, но в производствах органического синтеза используются и реакции разложения. Деление процессов органического синтеза и название их по видам реакций оправданы тем, что многие из них идут в кинетической области, т. е. общая скорость процесса u определяется скоростью реакции и вычисляется по уравнению
u = d x/ d t = k DC (1)
в котором движущая сила процесса DC равна произведению концентраций реагирующих веществ в соответствии с кинетическим уравнением, определяющим порядок реакции, а константа скорости подчиняется уравнению Аррениуса. В процессах органического синтеза, как правило, протекает не одна химическая реакция, а несколько параллельных и последовательных реакций. В результате кроме целевого продукта получаются еще побочные продукты и отходы производства. Соответственно количеству реакций константа скорости процесса может быть сложной функцией констант скоростей нескольких реакций:
k = f (k 1, k 2, k 3, k 4….) (2)
причем функциональная зависимость может сильно изменяться с повышением температуры, давления и концентрации реагирующих веществ и других параметров режима. Селективность процесса по целевому продукту определяется соотношением констант скоростей целевой и побочных реакций. Поэтому для интенсификации процессов органического синтеза часто применяют селективные катализаторы, ускоряющие лишь основную реакцию.
Полимеризацию, гидрирование и другие процессы, происходящие с уменьшением объема, часто проводят при повышенных и высоких давлениях для ускорения в повышения равновесного выхода продукта. При повышенном давлении целесообразно проводить процессы абсорбции газов, часто встречающиеся в органическом синтезе. Обратные процессы десорбции, дегидрирования, расщепления молекул с получением газообразных продуктов целесообразно проводить под вакуумом.
В газовых реакциях окисления, хлорирования, гидрирования и других движущую силу DС и скорость процесса u увеличивают варьируя температуру и давление, смещая тем самым равновесие в сторону целевого продукта. При проведении процессов сорбции увеличивают движущую силу процесса повышением концентрации реагирующих веществ или отводом готового продукта из зоны реакции. Применение различных средств интенсификации производственных процессов нередко ограничивается стойкостью органических соединений, что особенно проявляется в высокотемпературных процессах ввиду разложения исходных веществ и продуктов.
Наряду с катализаторами для увеличения константы скорости процесса в производстве органических полупродуктов используют инициаторы, фотосинтез и радиационное облучение. Под действием облучений можно проводить окисление парафиновых углеводородов, хлорирование бензола, полимеризацию этилена, получение привитых полимеров, вулканизацию каучука и т. п. Образовавшиеся продукты обладают более ценными свойствами, чем полученные обычным путем. Так, после облучения сульфохлорированный полиэтилен обладает повышенной теплостойкостью, а также стойкостью к действию кислот, сильных окислителей и в том числе к озону. Большим преимуществом радиационно-химических реакций является существенное сокращение, а в нёкоторых случаях даже отсутствие индукционного периода.
Для ускорения гетерогенных процессов, идущих в диффузионной области, применяют усиленное перемешивание фаз для замены молекулярной диффузии конвективной, что снижает диффузионные сопротивления препятствующие взаимодействию компонентов. Возможность применения тех или иных способов интенсификации определяется их экономической эффективностью, в частности сложностью аппаратурного оформления. Одновременно с внедрением новых технологических схем и процессов непрерывно улучшается и их аппаратурное оформление. Новые, более совершенные аппараты обеспечивают непрерывный процесс по всей технологической цепочке при комплексной переработке сырья. Современные заводы органического синтеза представляют собой соединение различных технологических цехов, не только вырабатывающих определенный (основной) продукт, но и включающих установки тщательно улавливающие и перерабатывающие большинство побочных продуктов, бывших ранее отходами.
Процессы органического синтеза влияют на технологические схемы нефтеперерабатывающих заводов, вызывая глубокое переплетение топливного и химического производства. В связи с тем, что производства органического синтеза многочисленны и разнообразны, ниже рассмотрены примеры типичных производств, имеющих большое народнохозяйственное значение.
3. СИНТЕЗ МЕТИЛОВОГО СПИРТА
Метиловый спирт (метанол) — важное соединение для получения, главным образом, формальдегида а также - диметилсульфата, диметилтерефталата метилацетата, диметилформамида, аитидетонационных смесей (тетраметилсвинец), ингибиторов, антифризов, метиламина, метилового эфира акриловой кислоты, лаков, красителей и других продуктов. В чистом виде применяется в качестве растворителя и может быть использован как высокооктановая добавка к моторному топливу.
Синтез метилового спирта по физикохимическим условиям его проведения и по технологическому оформлению аналогичен процессу синтеза аммиака. Синтез-газ, как и азотоводородную смесь, можно получать конверсией генераторных газов или природного газа. При синтезе метанола, как и при синтезе аммиака, взаимодействие смеси тщательно очищенных газов происходит при высоких давлении и температуре в присутствии катализаторов. И, наконец, из-за малого выхода конечных продуктов и тот и другой процессы являются циклическими, причем реакцию никогда не вёдут до полного превращения. Поэтому оба синтеза ведут на аналогичных установках, которые монтируют в составе одного завода. Для синтеза берут смесь газов при соотношении СО и Н2 от 1:4 до 1:8. Процесс ведут при 350 - 400 оС и 2?107 - 3?107 Н/м2 в присутствии смешанного цинко-хромового катализатора ZnO+Сr2О3. Основная реакция процесса
СО + 2Н2 = СН3ОН + 111 кДж
Одновременно, особенно при уменьшении давления или увеличении температуры сверх оптимальной могут протекать и следующие побочные реакции
СО + 3Н2 = СН4 + Н2О + 209 кДж (а)
2СО + 2Н2 = СН4 + СО2 + 252 кДж (б)
2СО = СО2 + С (в)
СО + Н2 = СН2О + 8,4 кДж (г)
2СН3-ОН = СН3-О-СН3 + Н2О (д) (диметиловый эфир)
СН3-ОН + nСО + 2nН2 = СН2(СН2)nОН + nН2О (е)
высшие спирты
СН3-ОН + Н2 = СН4 + Н2О (ж)
Количество тех или иных побочных соединений в продукциоиной смеси зависит не только от температуры и давления, но и состава исходной газовой смеси, селективности и состояния катализатора. Наиболее существенной примесью как правило является метан. По сравнению со всеми побочными процессами (а)—(ж) получение метилового спирта идет с максимальным уменьшением объема, поэтому в соответствии с принципом Ле-Шателье повышение давления двигает равновесие в сторону образования метилового спирта. Так как процесс экзотермичен, то при повышении температуры равновесие сдвигается влево и равновесная степень превращения синтез-газа в метиловый спирт уменьшается. В то же время при недостаточно высоких температурах скорость процесса чрезвычайно мала. Поэтому в промышленности процесс ведут в узком интервале температур с колебаниями в 20-30 °С.
Фактические выходы всегда ниже равновесных вследствие недостаточной избирательности применяемых катализаторов. Каталитическую способность для реакции синтеза метанола проявляют многие металлы. В промышленности используется цинк-хромовый катализатор, который получается осаждением оксидов цинка и хрома при соотношении ZnO:Сr2О3 ≈ 2:1. Катализатор восстанавливают в токе того же газа. Длительность работы такого катализатора без регенерации колеблется от 4 до 6 месяцев. Общая скорость реакции синтеза определяется адсорбцией водорода.
Температурная зависимость константы скорости прямой реакции описывается уравнением Аррениуса и соответствует энергии активации Е = 100 кДж/моль.
Интервал оптимальных температур соответствующих наибольшему выходу продукта определяется активностью катализатора, объемной скоростью газовой смеси и давлением. Для цинк-хромового катализатора при давлениях около 5?106—25?106 Н/м2 и объемных скоростях 20 000—40 000 ч-1 оптимальные температуры колеблются в пределах 360-380 0С. На низкотемпературных катализаторах, например на медь-цинк-алкалюминиевых катализаторах, используемых при 220-280 °С, процесс осуществляется при более низких давлениях 4?106—10?106 Н/м2.
В производстве процесс синтеза осуществляется при объемных скоростях 20 000— 40 000 ч-1 и выход метанола составляет около 4% за один проход. При увеличении объемной скорости до 100 000 ч-1 степень превращения исходной смеси за один проход уменьшается, но при циклической схеме с рециркуляцией газов количество полученного метилового спирта возрастает, так как степень превращения снижается медленнее, чем увеличивается объемная скорость.
Технологическая схема производства метилового спирта представлена на рис 14.2. Исходная смесь газов после предварительной очистки от примесей сжимается пятиступенчатым компрессором до 25×106 Н/м2. После каждой ступени сжатия установлены холодильник (не показанные на схеме), которые отбирают тепло сжатия. Затем газовая смесь смешивается в смесителе с циркуляциовным газом и, пройдя фильтр для очистки от масла, поступает в трубное пространство теплообменника, где нагревается примерно до 220 °С за счет тепла реакционных газов и далее направляется в колонну синтеза (высота 12-18 м, внутренний диаметр 0,8-1,2 м, толщина стенок 0,09-0,1 м).
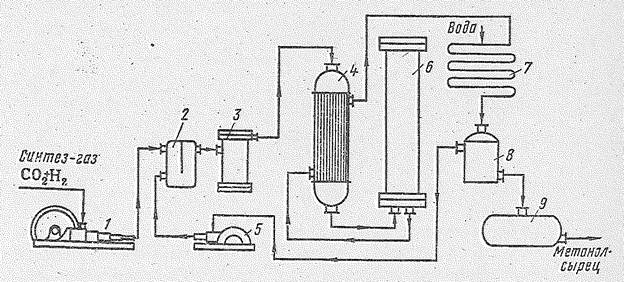
Рис. 14.2. Схема установки для синтеза метилового спирта из оксида углерода и водорода: 1 - компрессор; 2 - смеситель; 3 - фильтр; 4 - трубчатий теплообменник; 5 - циркуляционный компрессор; 6 колонна синтеза; 7 - холодильник-конденсатор; 8 – сепаратор; 9 - сборник спирта-сырца.
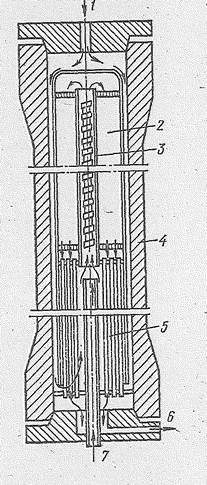 | Рис. 14.3. Схема колонны синтеза метанола: 1 - вход основного газа; 2 - катализаторная коробка; 3 - электроподогреватель; 4 - корпус колонны; 5 - теплообменник; 6 - выход газа; 7 - вход байпасного газа. |
Требуемая температура в колонне поддерживается за счет тепла реакции, часть которого отбирает идущая по теплообменным трубкам исходная газовая смесь, поступающая затем в катализаторную массу. При необходимости регулирования температуры в колонну вводят холодную смесь тазов.
Колонны синтеза различаются по типу насадки. В полочной колонне катализатор расположен на нескольких полках и газ последовательно проходит один слой за другим. На рис. 14.3 приведена схема колонны синтеза, в которой в одном корпусе совмещены катализаторная коробка, электроподогреватель и теплообменник. Синтез-газ вводится сверху и проходит по кольцевому пространству между корпусом колонны и коробкой. Затем газ поступает в межтрубное пространство теплообменника, где подогревается за счет тепла контактных газов, проходящих по трубкам теплообменника. В колонне такого типа лучше осуществляется теплообмен и тем самым обеспечивается приближение к оптимальной температуре. Колонна работает в режиме, близком к идеальному вытеснению. Контактные газы выходят из нижней части колонны и, отдав свое тепло исходной газовой смеси в теплообменнике, направляются через водяной ходильник-конденсатор в сепаратор. Здесь полученный спирт-сырец (концентрация 96%) отделяется от непрореагировавшего газа, который циркуляционным компрессором дожимается до давления исходного газа и направляется в смеситель, а метиловый спирт поступает в сборник спирта-сырца.
В связи с тем, что в циркулирующей газовой смеси скапливаются различные примеси и продукты побочных реакций (метан, азот, двуокись углерода к др.), ее периодически обновляют, сжигая часть возвращаемого газа. Для получения 1 т метилового спирта расходуется примерно 700 м3 СО и 1400-2000 м3 Н2 (из 1 м3 синтез-газа газа образуется около 400 г спирта т. е. выход составляет от 84 до 87% от теоретического).
Окись углерода реагирует с углеродистой сталью, образуя пектакарбокил железа Fе(СО)5, который разлагаясь на катализаторе, быстро покрывает его слоем дисперсного железа, усиливающего побочные реакции образования метана, что, в свою очередь нарушает оптимальный температурный режим. Для предотвращения карбонильной коррозии стенки колонны и некоторые другие детали футеруются медью или выполняются из высоколегированной стали. Полученный метанол-сырец очищают от сложных эфиров, высших спиртов, пентакарбонила железа, что в сочетании с последующей ректификацией позволяет получить чистый метиловый спирт.
Для разогрева газовой смеси в пусковой период внутри колонны синтеза вмонтирован электроподогреватель. Изменяя условия синтеза: температуру, давление, соотношение СО и Н2 в исходной смеси, состав катализатора - можно получить не только метиловый, но и высшие спирты, альдегиды, кетоны, эфиры, органические кислоты, предельные и непредельные углеводороды любой длины цепи, вплоть до твердых парафинов, но преимущественно неразветвленной структуры. Исходная смесь газов должна быть тщательно очищена от вредных примесей: сернистых соединений, смол и пыли.
4. ПРОИЗВОДСТВО ЭТИЛОВОГО СПИРТА
Этилен СН2=СН2, пропилен СН3-СН=СН2, бутилен СН3-СН2-СН=СН2,
бутадиен (дивинил) СН2=СН-СН=СН2 будучи очень реакционноспособными соединениями играют важную роль в промышленности органического синтеза. Из многочисленных реакций в которые вступают олефины наибольшее практическое значение имеют процессы полимеризации (полиэтилен, полипропилен, полиизобутилен и др.), гидратации (спирты), хлорирования (дихлорэтан, хлористый аллил и т.п.), окисления (окись этилена), оксосинтеза и некоторые другие реакции. Широкое распространение получили процессы гидратации олефиновых углеводородов. Таким способом получаются этиловый, изопропиловый и другие спирты. В настоящее время этиловый спирт по объему производства занимает первое место среди всех других органических продуктов. С каждым годом спирт, поучаемый из пищевого сырья, все более и более заменяется синтетическим, гидролизным и сульфитным. 1 т этилена позволяет сэкономить более 4 т зерна. Синтетический спирт из этилена в несколько раз дешевле пищевого и требует меньших затрат труда. Синтетический спирт широко применяется в различных отраслях промышленности для получения синтетического каучука, целлулоида, ацетальдегида, уксусной кислоты, искусственного шелка, лекарственных соединений, душистых веществ, бездымного пороха, в качестве растворителя и т.п.
Гидратация этилена осуществляется двумя методами: при помощи серной кислоты (сернокислотная гидратация) и непосредственным взаимодействием этилена с водяным паром в присутствии твердых катализаторов (парофазная каталитическая гидратация). Сернокислотный способ, открытый А. М. Бутлеровым, получил промышленное осуществление только в послевоенные годы. Он состоит из следующих четырех стадий: 1) абсорбция этилена серной кислотой с образованием сернокислых эфиров; 2) гидролиз эфиров; 3) выделение спирта и его ректификация; 4) концентрирование серной кислоты. Взаимодействие меду этиленом серной кислотой состоит из двух этапов: первый — физическое растворение этилена в серной кислоте и второй — гомогенное взаимодействие обоих, компонентов (Ж-Ж) с образованием алкилсульфатов по уравнениям:
C2H4 + H2SO4 = C2H5OSO3H (а)
C2H5OSO3H + C2H4 = (C2H5O)2SO2 (б)
Диэтилсульфат в условиях процесса может взаимодействовать с серной кислотой, образуя этилсульфат:
(C2H5O)2SO2 + H2SO4 = 2C2H5OSO3H (в)
Этилен поглощается серной кислотой медленнее, чем другие газообразные олефины (например в сотни раз медленнее, чем изобутилен). По мере образования этилсерной кислоты (этилсульфата), в которой этилен растворяется лучше, скорость поглощения этилена увеличивается. Но в связи с тем, что в то же время уменьшается концентрация серной кислоты, общая скорость реакции снижается. Нужная степень насыщения до 0,6 моля С2Н4 на 1 моль Н2SО4 в верхней части абсорбционной колонны достигается для 97,5% -ной кислоты за 1ч 15 мин, т. е. почти вдвое быстрее, чем для 95% -ной кислоты (2ч 15 мин). Следовательно, целесообразно применять 97-98%-ную кислоту. Оптимальная температура процесса 65-75 °С. С дальнейшим повышением температуры уменьшается количество образующейся этилсерной кислоты. С повышением давления возрастают скорость абсорбции и степень насыщения серной кислоты этиленом. Большое значение для процесса имеет интенсивность перемешивая. В производстве применяют барботажные колонны, обеспечивающие более сильное перемешивание, чем насадочные башни. В ходе второй стадии идет гидролиз этил- и диэтилсульфата по уравнениям:
C2H5OSO3H + Н2О = C2H5OН + H2SO4 (г)
(C2H5O)2SO2 + 2Н2О = 2C2H5OН + H2SO4 (д)
Кроме основных реакций (г) и (д) идет образование диэтилового эфира:
(C2H5O)2SO2 + C2H5OН = C2H5OC2H5 + C2H5OSO3H (е)
(C2H5O)2SO2 + Н2О = C2H5OC2H5 + H2SO4 (ж)
ацетальдегида, а также наблюдается полимеризация этилена. Для уменьшения выхода диэтилового эфир гидролиз ведут по возможности быстрее, сразу же отгоняя образующийся спирт с тем, чтобы его концентрация в растворе была небольшой.
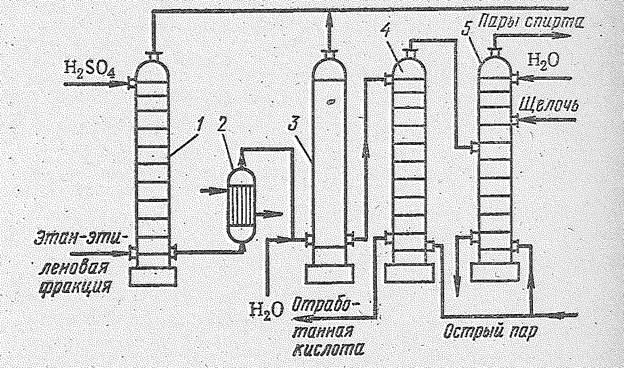
Рис. 14.4. Принципиальная схема производства этилового спирта сернокислотной гидратацией этилена: 1 – абсорбер; 2 – теплообменник; 3 – гидролизер; 4 – отпарная колонна; 5 – нейтрализационная колонна.
Принципиальная технологическая схема производства спирта сернокислотной гидратацей этилена приведена на рис. 14.4. Этиленовая фракция нефтепереработки, содержашая 60-75% этилена, под давлением 20?105-25?105 Н/м2 поступает в нижнюю часть тарельчатого абсорбера (около 20 тарелок с колпачками), футерованного кислотоупорными плитками, и барботирует через слой кислоты, имеющейся на каждой тарелке. Концентрированная кислота (97-98%-ная Н2SО4) подается для орошения в верхнюю часть абсорбера. При абсорбции этилена серной кислотой выделяется большое количество тепла (121 кДж на 1 моль этилена), которое непрерывно отводится водяными холодильниками, расположенными над каждой тарелкой таким образом, чтобы температура в абсорбере не превышала 80 °С. Непоглощенные газы, в основном этан и другие примеси, содержащие не более 2-5% этилена, промываются водой и 10%-ным раствором щелочи в специальных скрубберах. Сернокислотный раствор из абсорбера направляется в гидролизер с керамической насадкой, где разбавляется водой (до концентрации 50% Н2SО4). Температура в гидролизере поддерживается, в пределах 100-110 °С и давлении 2?105-3?105 Н/м2. Время гидролиза 30 мин. Выделившиеся растворенные газы, содержащие небольшое количество паров диэтилового эфира, выводятся из верхней части гидролизера, промываются и нейтрализуются. В растворе, выходящем из гидролизера, содержатся этиловый спирт, вода, 43-50%-ная серная кислота, диэтиловый эфир, растворенные газы и непрогидролизовавшиеся этилсульфаты. Вся эта смесь поступает в отпарную колонну (1,5?105 Н/м2, 95-125 °С), где происходит окончаельный гидролиз. Выходящая парогазовая смесь далее направляется на промывку, нейтрализацию и конденсацию. Полученный спирт-сырец поступает затем на ректификацию. Слабая серная кислота отводится на очистку от смолистых примесей и после концентрирования и добавки олеума снова подается в абсорбер.
Для получения 1 т спирта на абсорбцию идет около 2 т концентрированной серной кислоты, а затем приходится упаривать уже 4 т кислоты. Такой кислотооборот осложняет производство в вызывает значительные трудности из-за сильной коррозии и тяжелых условий труда. По сернокислотному методу из 1 т этилена вырабатывается 1,2 т спирта-ректификата и около 100 кг этилового эфира. Превращение этилена в спирт достигает 90%.
В настоящее время всё большее распространение получает более совершенный метод - парофазная каталитическая гидратация, осуществляемая по циклической схеме. Процесс гидратации — экзотермическая равновесная реакция:
С2Н4 + Н2О = C2H5OН + 45,6 кДж
Как следует из уравнения реакции в термодинамических данных, чтобы равновесие сдвинуть в сторону гидратации этилена, необходимо понижение температуры и повышение давления, однако при температуре ниже 280 °С скорость гидратации очень мала, а применение давления свыше 80?105 Н/м2 экономически не рентабельно.
В качестве катализатора используется фосфорная кислота, нанесенная на широкопористые носители: кизельгур, силикагель, алюмосиликат. Носители, обладающие широкими порами, облегчают протекание диффузии реагентов внутрь зерен пористого катализатора. Так как данный кислотногетерогенный катализ осуществляется свободной кислотой, находящейся в виде жидкой пленки (абсорбирующей пары воды из газовой фазы) на поверхности носителя, то активность катализатора зависит от концентрации кислоты, которая в свою очередь зависит от парциального давления паров воды. В результате обширных исследований и промышленных испытаний установлены основные условия взаимодействия газообразного этилена и водяных паров: 1) температура 280-290 оС; 2) давление 70?105-80?105 Н/м2 3) концентрация этилена в циркулирующем газе 80-85 об. %; 4) молярное отношение воды к этилену 0,6-0,75: 1 и 5) концентрация фосфорной кислоты на поверхности катализатора не ниже 83%; 6) объемная скорость 1800—2500 ч-1. Перечисленные условия позволяют получать водноспиртовой раствор концентрацией спирта 15—16% при конверсии этилена за один проход 4-5%. Полезное использование этилена составляет 95%. Остальные 5% этилена расходуются на получение диэтилового эфира (2%), ацетальдегида (1%) димеров и полимеров (2%).
Технологическая схема прямой гидратации этилена (рис. 14.5) состоит из нескольких непрерывно протекающих операций: 1) приготовления исходной парогазовой смеси, 2) гидратации этилена, 3) нейтрализации паров продуктов, образующихся в результате реакции, 4) рекуперации тепла рециркулирующих потоков и 5) очистки циркулирующего газа.
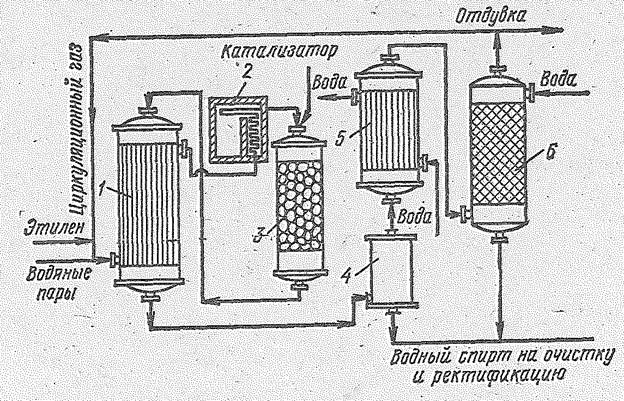
Рис. 14.5. Принципиальная схема установки для производства этилового спирта каталитической гидратацией этилена в паровой фазе: 1 — трубчатый теплообменник 2 — печь; 3 — реактор; 4 — сборник; 5 — холодильник; 6 — промывная колонна с насадкой.
Гидратация этилена проводится в контактном аппарате, который для защиты от коррозии выкладывается красной медью. Этилен, сжатый компрессором, смешивается с водяными парами и вся смесь направляется в теплообменник и затем в печь, откуда парогазовая смесь при 280 °С поступает в гидрататор, который заполнен твердым катализатором на высоту 8,5 м. Время контакта 18-20 с. Необходимую для процесса температуру исходной смеси можно получить смешением этилена с перегретым паром высокого давления (около 70?105 Н/м2). По режиму работы гидрататор приближается к адиабатическому реактору идеального вытеснения.
Образовавшаяся в результате реакции смесь продуктов последовательно отдает тепло в теплообменнике, конденсируется водный раствор спирта в емкости и затем окончательно охлаждается в холодильнике. Полная отмывка газа от паров спирта идет в скруббере. Непрореагировавший этилен после сжатия вновь направляется в гидрататор, а спирт-сырец подвергается ректификации. На 1 т этилового спирта расходуется 0,685 т этилена, 5,6 кг фосфорной кислоты, 2 кг носителя и 16 кг едкого натра. Срок службы катализатора равен примерно 600 ч. Введением распыленной фосфорной кислоты в реактор в ходе процесса можно продлить службу катализатора, после чего его нужно заменять, так как на поверхности осаждаются смолистые соединения. Парофазная каталитическая гидратация этилена является более перспективной, чем сернокислотная.
Для производства синтетических каучуков применяют соединения с сопряженной системой двойных связей: дивинил (бутадиен-1,3), изопрен, хлоропрен и с одной двойной связью: изобутилен, стирол, a-метилстирол, нитрил акриловой кислоты и др. Большинство из этих соединений образуется дегидрированием соответствующих углеводородов, содержащихся в промышленных нефтяных газах, попутных газах, газовом бензине, некоторых фракциях переработки нефти, а также синтетически. (например, этилбензол и изопропилбензол). Получение. дивинила осуществляется контактным разложением этилового спирта, а также дегидрированием бутана и бутиленов в одну или две стадии. Получение дивинила из спирта по способу, разработанному С. В. Лебедевым, является примером каталитического обратимого эндотермического процесса широко применяемого в промышленности.
5. ПРОИЗВОДСТВО АЦЕТИЛЕНА И ЕГО ПЕРЕРАБОТКА
Среди многочисленных газообразных углеводородов ацетилену принадлежит особое место. Практическое применение и использование ацетилена исключительно велико и многообразно. Так как ацетилен - соединение ненасыщенное, то его молекулы легко вступают в самые различные химические реакции и получаемые многочисленные производные дают начало большому
количеству важных для народного хозяйства веществ. В настоящее время ацетилен получают из карбида кальция и углеводородного сырья.
Производство ацетилена разложением карбида кальция осуществляется в ацетиленовых генераторах мокрым и сухим способами по уравнению реакции:
СаС2 + Н2О = С2Н2 + Са(ОН)2+ 127 кДж
При мокром способе в генераторах, работающих по принципу «карбид в воду», дробленый карбид кальция равномерно подается в генератор, содержащий большое количество воды, за счет нагревания которой и отводится выделяющиеся в ходе процесса тепло. Воды берется десятикратное количество по отношению к весу карбида. Применяемая по этой схеме аппаратура и особенно коммуникации для удаления образующегося шлама и циркуляция воды очень громоздки. Кроме того, большие затруднения вызывают транспортировка, хранение и использование жидкого известкового молока, содержащего до 70% воды.
При сухом способе в генераторах, работающих по принципу «вода на карбид», воду добавляют только в таком количестве, чтобы обеспечить протекание реакции и отвод тепла за счет испарения избытка воды. В этом способе карбид кальция из бункера со шлюзовым затвором шнеком подается на верхнюю полку генератора (диаметр 3—5, высота7,5 м; 11 полок), устройство которого подобно механическим полочным печам. Необходимое количество воды подается разбрызгивающим устройством на верхнюю полку и обильно смоченный карбид кальция перемещается гребками по спирали сверху вниз через отверстия, устроенные в полках попеременно: в центре и на периферии (рис. 14.6).
 | Рис. 14.6. Схема производства ацетилена из карбида кальция: 1 - приемный бункер; 2 - автоматический затвор; 3 - буферный бункер; 4 - шнек; 5 - ацетиленовый генератор; 6 - шнек для удаления извести; 7 - скруббер; 8 – отстойник. |
Передвигаясь с полки на полку, карбид одновременно перемешивается и практически полностью (на 98%) превращается в ацетилен и Са(ОН)2. Гидрооксид кальция в виде сухого порошка (пушонка) через конусную часть генератора с мешалкой удаляется шнеком. Выделившийся в результате реакции ацетилен вместе с водяными парами и увлеченной известковой пылью при 100 °С направляется в скруббер, орошаемый водой. Здесь газ охлаждается до 20-30 оС и освобожденный от пыли поступает на очистку от фосфористого водорода (300—600 мг/м3) сероводорода (200—400 г/м3) и аммиака. Образовавшееся известковое молоко из нижней части скруббера непрерывно выводится в отстойник. Шлам из нижней части отстойника откачивается в канализацию, а осветленная вода насосом через холодильник снова направляется в скруббер. Очистка газа от примесей обеспечивается промывкой водным раствором гипохлорита с добавкой активного хлора или раствором бихромата натрия в разбавленной серной кислоте. Затем газ сушится и направляется на химическую переработку.
Карбидный метод несмотря на сравнительную простоту имеет ряд крупных недостатков, из которых в первую очередь необходимо отметить громоздкость оборудования, высокий расход электроэнергии на производство карбида (10—11 кВт-ч на 1 кг ацетилена) и затруднения с использованием отходов, получающихся в большом количестве. В последние годы разработаны эффективные промышленные способы получения ацетилена на основе углеводородного сырья. Процесс образования ацетилена из метана и его гомологов (например этана) при нагревании без доступа воздуха может быть представлен следующими реакциями крекинга:
2СН4 ® СНºСН + 3Н2 – 376 кДж С2Н6 ® СНºСН + Н2 – 330 кДж и т.д.
Побочная реакция СН4 = С + 2Н2 - 88 кДж. Повышение температуры и уменьшение давления позволяют сместить процесс в сторону конечных продуктов. Но при 1400—1500 °С ацетилен и углеводороды термодинамически неустойчивы и разлагаются на сажу и водород:
С2Н2 «2С + Н2 + 229 кДж
или ацетилен взаимодействует с другими газами или парами воды по реакциям:
С2Н2 + 2Н2О ® 2СО + 3Н2 С2Н2 + 2СО2 ® 4СО + Н2
Реакция превращения метана в ацетилен при 1400—1500 °С идет быстрее реакции распада ацетилена на элементы. Это вместе с закалкой и обеспечивает возможность получения ацетилена. Равновесные выходы ацетилена из метана при атмосферном давлении возрастают с повышением температуры.
В то же время при более низких температурах скорость основных реакций очень мала. Поэтому для достижения максимальных выходов ацетилена и уменьшения различных побочных реакций необходимо применять высокие объемные скорости газа, при которых сырьё должно находиться в реакционной зоне только тысячные доли секунды при температурах выше 1400 °С. Затем быстро охлаждают образующиеся продукты («закалка»), что позволяет предупредить разложение ацетилена.
Способы производства ацетилена из природного и других углеводородных газов: 1) электрокрекинг газообразных углеводородов или жидких продуктов (смол и тяжелых нефтяных остатков); 2) термический крекинг и 3) термоокислительный пиролиз.
Электрокрекинг проводится в реакторе (рис. 14.7), дуга в котором создается постоянным током между электродами. Исходная газовая смесь с большой скоростью (более 100 м/с) под избыточным давлением 0,5?105 Н/м2 входит по касательной в верхнюю расширенную часть реактора, выполненную в виде стального пустотелого цилиндра, проходит зону действия электрической дуги (1600 °С) и выходит из нее по охлаждаемой водой узкой трубе, являющейся анодом. Газы, пропускаемые здесь с большой скоростью (600-1000 м/с), в конце трубы имеют температуру 600 °С; непосредственным впрыскиванием воды обеспечивается их быстрое охлаждение до 150 °С («закалка»). Образовавшийся при этом в результате испарения воды перегретый водяной пар уходит вместе с реакционными газами. Для выделения ацетилена используют растворители: воду, ацетон, диметилформамид и др. Для «зажигания» дуги при пуске реактора применяют пусковой электрод. Расход электроэнергии на 1 кг концентрированного ацетилена составляет примерно 10 кВт-ч. Конверсия метана за один пропуск через реактор составляет 40—50%. Содержание ацетилена в газе до 14%. Данным методом можно перерабатывать метан природного газа и пары гомологов метана, что является одним из достоинств этого метода.
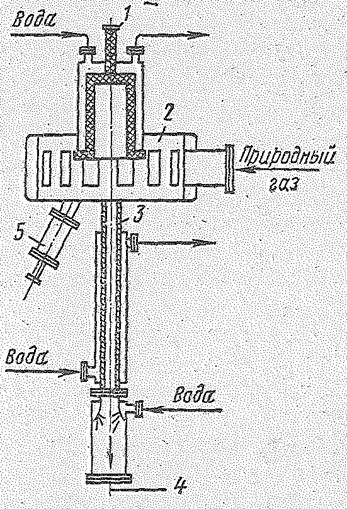 | Рис. 14.7. Реактор для электрокрекинга: 1- катод; 2 -реакционная камера; 3 - заземленный анод; 4 - вывод газов крекинга; 5 - пусковой электрод. |
Термический крекинг осуществляется в регенеративных печах при 1450—1600 °С. Газ соприкасается с поверхностью заранее нагретой насадки. При наличии двух печей, соединенных одной топкой, можно обеспечить непрерывный процесс по циклу: 1 мин - нагрев насадки и 1 мин - крекинг, что способствует максимальному использованию тепла. Осуществлен также крекинг пропана в трубчатых печах при 1100—1200 °С, времени реакции 0,1-0,15 с и остаточном давлении 380 мм рт. ст.
Более широко распространен термоокислительвый крекинг (пиролиз) в котором необходимое тепло получается за счет сжигания части метана:
СН4 + 2О2 ® СО2 + 2Н2О + 802 кДж
Основные реакции термоокислительного крекинга
СН4 + 1/2О2 ® СО + 2Н2+ 32,0 кДж, 2СН4 = С2Н2 + 3Н2 - 376 кДж
В печи пиролиза поддерживается температура около 1450 °С. Для окисления применяется кислород, взятый в количестве 60— 65 об. % от метана. Оба газа предварительно раздельно подогреваются до 400—600 °С и затем с большой скоростью подаются в реакпионный канал, где находятся примерно 0,003-0,006 с. Созданная в Советском Союзе конструкция печи отличается от зарубежных своей компактностью, большей производительностью при меньшем расходе кислорода. Применяются одноканальные и многоканальные реакторы. Конверсия метана в ацетилен составляет 30%.
Установлено, что при подаче бензина в зону закалки при окислительном пиролизе метана можно значительно увеличить выход ацетилена; этилена и синтез-газа. Так как метод пиролиза и состав исходного сырья в значительной степени влияют на состав конечного газа, схемы выделения ацетилена могут сильно отличаться друг от друга.
При производстве ацетилена из метана одновременно с основным продуктом получаются большие количества водорода и других газов (табл. 1). Так, на каждую 1 т ацетилена образуется водорода в количестве, достаточном для производства 3-4 т аммиака. При электрокрекинге выделяется еще 50—100 кг сажи. Газы термоокислительного крекинга содержат окись углерода и водород в соотношении, требуемом для синтеза углеводородов или метанола (1 т метана по этому методу дает примерно 1160 кг синтез-газа).
Одним из важнейших промышленных синтезов на основе ацетилена является производство ацетальдегида. Из ацетилена он может быть получен
Таблица 1.
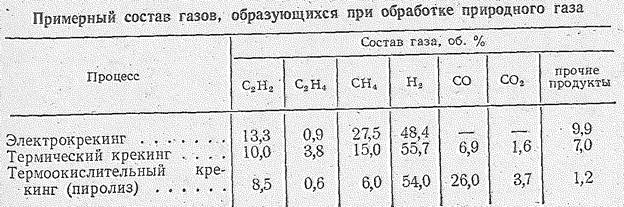
тремя методам: 1) гидратацией ацетилена в жидкой фазе с ртутно-железным катализатором (Способ М.Г. Кучерова, открытый в 1881 г.); 2) гидратацией ацетилена в паровой фазе на твердом катализаторе; 3) гидролизом простых виниловых эфиров. Кроме того, ацетальдегид производят неполным каталитическим окислением этилового спирта и каталитическим окислением этилена (наиболее перспективный метод). Производство ацетальдегида на основе реакции Кучерова осуществляется в промышленности по схеме, приведенной на рис. 14.8. Тщательно очищенный ацетилен, смешанный с циркулирующим

Рис. 14.8. Схема получения ацетальдегида гидратацией ацетилена в жидкой фазе: 1 - барботажный гидрататор; 2 и 3 — трубчатые холодильники; 4 – барботажная колонна; 5 - сборник ацетальдегида.
газом под давлением 1,5?105 - 2,5?105 Н/м2, непрерывно барботирует в гидрататоре (высота 15, диаметр узкой части 1,34 м) через контактную жидкость, содержащую раствор сульфата ртути (II) в серной кислоте. Так как ацетальдегид – сильный восстановитель, ходе процесса идет восстановление ртути (II) до ртути (I), а затем до металлической ртути:
2HgSО4 + Н2O + CH3СНО ® Нg2SО4 + Н2SO4 + СН3СООН (а)
Нg2SО4 + Н2О + CН3СНО ® 2Нg + Н2SО4 + СН3СООН (б)
Для сохранения необходимого состава катализаторной жидкости вводят металлическую ртуть и окислители, которые в присутствии серной кислоты переводят Hg в сульфат ртути (II), требуемую для процесса гидратации
H2SО4
2Нg + Fе2(SО4)3 ===== Hg2SO4 + 2FеSО4 (в)
Нg2SО4 + Fе2(SО4)3 ® 2НgSО4 + 2FеSО4 (г)
Металлическую ртуть вводят периодически распыляя ее через воронку в верхней части реактора (на каждую тонну ацетальдегида безвозвратно теряется около 0,1 кг ртути). При этом 50-60% ацетилена гидратируется по уравнению реакции
СНºСН + Н2О ® СН3-СНО + 151 кДж
Аппарат в виде колонны с расширением в верхней части, которое служит для улавливания брызг и вместилищем для образующейся пены, изготовляется из ферросилиция или из нержавеющей стали. Каждая полка барботажной гидратационной колонны по степени перемешивания газа и жидкости ближе к режиму смешения, чем к режиму вытеснения. Движение фаз происходит на полке по схеме перекреcтного тока. Однако вследствие значительного количества полок процесс можно рассчитывать по модели вытеснения при противоточном движении фаз. Температура в гидрататоре при помощи острого пара поддерживается в пределах 90-100 оС. Газы, выходящие из верхней части гидрататора и содержащие ацетальдегид, непрореагировавший ацетилен, водяные пары и другие примеси, поступают в холодильники. В первом конденсируются к пары воды, возвращаемые в гидрататор, а во втором — ацетальдегид и вода, направляемые в сборник. Несконденсировавшиеся газы подаются в абсорбер, где альдегид извлекается водой, охлажденной до 10 °С, а непрореагировавший ацетилен возвращается снова в процесс. При этом около 10% газа непрерывно отбирается на очистку от азота и двуокиси углерода, чем и предотвращается их чрезмерное накопление в циркулирующем газе. Ацетальдегид далее подвергается ректификации. Выходящая из гидрататора катализаторная жидкость направляется в отстойник (для улавливания ртути) и затем на регенерацию. Катализаторная жидкость содержит примерно 200 г/л серной кислоты, 0,5-0,6 г/л окиси ртути и 40 г/л окислов железа.
Выход ацетальдегида на прореагировавший ацетилен составляет 90-95%. Для получения 1 т ацетальдегида расходуется 680 кг ацетилена, 0,1 кг ртути, около 3 т водяного пара, а также некоторое количество серной и азотной кислот и железного купороса. В ходе процесса в виде побочных продуктов выделяются уксусная кислота, кротоновый альдегид и паральдегид.
Так как ртуть очень ядовита и ее применение нежелательно, были предложены нертутные катализаторы в виде окислов Zn, Мg, Ni, Fе, Со, Сr и других металлов, а также некоторые соли и кислоты. Такого рода гетерогенный каталитический процесс может быть провёден и во взвешенном слое. Выход ацетальдегида 88—90% на прореагировавший ацетилен. Конверсия ацетилена за проход ≈ 50%.
Производство уксусной кислоты с давних пор осуществляется сухой перегонкой дерева, брожением этилового спирта и с начала ХХ в. синтетически: окислением ацетальдегида или гидратацией кетена. При окислении ацетальдегида кислородом воздуха в присутствии солей марганца сначала образуется надуксусная кислота:
СН3-СНО + О2 ® СН3-СОООН
которая при взаимодействии со второй молекулой ацетальдегида дает две молекулы уксусной кислоты:
СН3-СОООН + СН3-СНО = 2СН3-СООН
Накопление надуксусной кислоты в реакционном аппарате может вызвать взрыв. Для предотвращения этого разбавляют парогазовую смесь азотом и поддерживают температуру в пределах 60—75 °С. Применяемые в качестве катализатора соли марганца способствуют восстановлению надуксусной кислоты в уксусную. Процесс осуществляется в барботажной окислительной колонне подобно той, которая используется для получения ацетальдегида. Производство состоит из трех стадий: 1) окисление ацетальдегида; 2) абсорбция ацетальдегида из отходящих газов и 3) выделение ацетальдегида из уксусной кислоты. В нижнюю часть колонны (рис. 14.9) вводится раствор
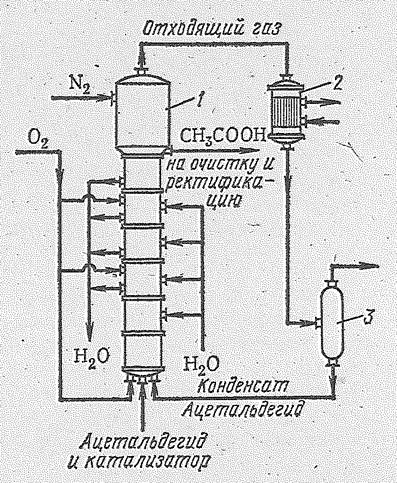 | Рис. 14.9. Схема получения уксусной кислоты окислением ацетальдегида: 1 - окислительная колонна; 2 - конденсатор; 3 - сепаратор. |
ацетальдегида и катализатор раствор ацетата марганца. Реакционная смесь занимает всю колонну, за исключением верхней части, в которую во избежание взрыва паров подается азот. В разных местах колонны по ее высоте вводится кислород. Окисление ведется при 60-70 °С и давлении 2?105 Н/м2. Выделяющееся тепло отводится циркуляцией жидкости и охлаждением колонны водяной рубашкой или водяными эмеевиками. Образующаяся уксусная кислота вместе с побочными продуктами реакции (уксусный ангидрид, муравьиная кислота, вода и др.) отводится на очистку и ректификацию. Смесь паров ацетальдегида, уксусной кислоты и других веществ из верхней части колонны направляется в холодильник — конденсатор, а затем в сепаратор, откуда непрореагировавший ацетальдегид направляется снова в реакционную колонну. А отходящий газ после промывки выпускается в атмосферу.
6. ПРОИЗВОДСТВО КАПРОЛАКТАМА
Капролактам (лактам e-аминокапроновой кислоты, 2-оксо-гексаметиленимин) представляет бесцветное кристаллическое вещество с
 |
температурой плавления 68,8 °С, температурой кипения 262,5 °С и плотностью 1,02 т/м3 (при 70°С). Хорошо растворим в воде (525 г в 100 г воды), бензоле, ацетоне, этаноле, диэтиловым эфире, плохо растворим в алифатических углеводородах. Растворяется в разбавленной серной кислоте, гидролизуясь до e-аминокапроновой кислоты. Гигроскопичен. При нагревании с концентрированными минеральными кислотами капролактам образует соли. В присутствии каталитических количеств воды, спиртов, аминов и органических кислот при нагревании поли-меризуется с образованием полиамида.
Температура вспышки капролактама составляет 135 оС, температура самовоспламенения 400°С. Капролактам раздражает кожу, ПДК равна 10 мг/м3. Транспортируется и хранится в твердом состоянии в мешках, или в виде расплава в цистернах с обогревом в атмосфере азота.
Капролактам получают различными методами из ароматического (бензол, толуол, фенол) и неароматического (циклогексан, фурфурол, ацетилен, окись этилена) сырья. Во всех методах промежуточным продуктом является циклогексаноноксим, изомеризацией которого получается капролактам. Промышленное значение имеют следующие методы производства циклогексаноноксима.
1. Из фенола через циклогексанол с последующим его дегидрированием до циклогексанона (фенольный метод):
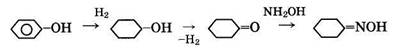
2. Из толуола через бензойную кислоту с последующим гидрированием ее до циклогексанкарбоновой кислоты и обработкой последней нитрозилсерной кислотой (толуольный метод):
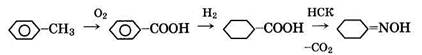
3. Из анилина через циклогексиламин с последующим отщеплением аммиака при действии воды (анилиновый метод):
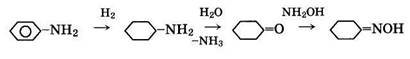
4. Из циклогексана, выделенного из нефтяного сырья, или полученного гидрированием бензола, следующими методами:
— окислением воздухом через циклогексанол и циклогексанон:
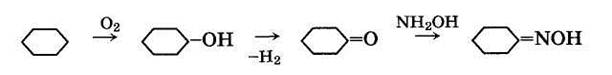
— фотонитрозированием хлористым нитрозилом:
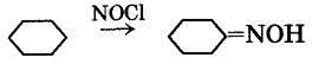
— нитрованием через нитроциклогексан с последующим восстановлением до нитрозоциклогексана (нитроциклогексановый метод):


 HNO3 H2 H2
HNO3 H2 H2



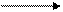 –NO2 –NO2 =NOH
–NO2 –NO2 =NOH
 |
5. Из бензола восстановлением до циклогексана и далее по схеме 14.10 (бензольный метод).
Рис. 14.10. Взаимосвязь промышленных методов производства циклогексаноноксима из различного сырья
Из этих методов наиболее распространенным является бензольный (в схеме на рис. 14.10 показан пунктиром). По данным 1985 года из всего мирового производства капролактама в 2,7 млн. т из бензола было получено 83,5%, из фенола 12,0% и из толуола 4,5%. По сравнению с фенольным методом бензольный метод отличается более низкой стоимостью сырья, меньшим числом стадий и меньшим расходом неорганических реагентов. Поэтому себестоимость капролактама, полученного бензольным методом, составляет 85% от себестоимости продукта, производимого из фенола.
Капролактам используют главным образом в качестве мономера для производства поликапролактама, перерабатываемого в капроновое волокно и полиамидные пластические массы. Незначительное количество капролактама применяется в качестве полупродукта для получения незаменимой аминокислоты L-лизина (а,е-диаминокапроновая кислота).
История. Капроновая кислота СН3(CH2)4СООН была выделена в 1817— 23 гг. М. Шеврелем в процессе систематического изучения жиров. Синтез и полимеризация e-капролактама были впервые осуществлены в конце XIX столетия. Промышленное производство e-капролактама как мономера для получения капронового волокна было организовано на основе исследований В. Карозерса (1930 г.) и Шлака (1940 г.) в конце 40-х годов по фенольному методу. В последующие годы были внедрены в промышленность методы производства капролактама фотонитрозированием (1951 г.), из циклогексанона через капролактон (1966 г.) и другие.
На основе работ З.А. Роговина, И.Л. Кнунянца, А.А. Стрепихеева, Э.В. Хаита и др. в 1949 г. на Дзержинском химическом комбинате создается первое в стране производство капролактама из фенола. В 1961—65 гг. подобные производства строятся на химических заводах в Чернигове, Рустави, Курске, Кемерово и Барнауле. В 1963 г. на Лисичанском химическом комбинате организуется производство капролактама из бензола через циклогексан. В период 1967—77 гг. создаются новые производства капролактама более экономичным методом прямого окисления циклогексана до циклогексанона, который к 1977 г. становится преобладающим.
6.1. Структурная схема производства капролактама из бензола через циклогексан
Наиболее распространенный в промышленности технологический процесс производства капролактама из бензола включает стадии:
— гидрирование бензола,
— окисление циклогексана,
— дегидрирование циклогексанола,
— оксимирование цклогексанона,
— изомеризация циклогексаноноксима в капролактам.
Структурная схема подобного процесса представлена на рис. 14.11.
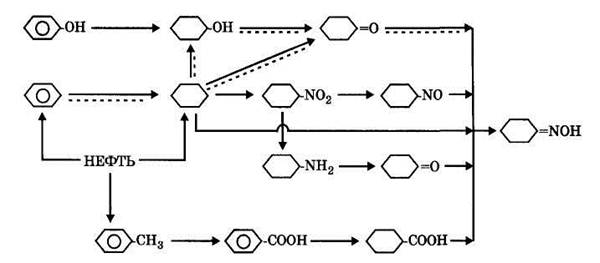
1. Гидрирование бензола до циклогексана протекает над никелевым катализатором на носителе оксиде хрома (III) при температуре 130—220 °С и давлении 1 МПа:
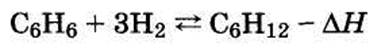
 |
Рис. 14.11. Структурная схема производства капролактама из бензола
2. Окисление циклогексана протекает в жидкой фазе кислородом воздуха при температуре 140-160 оС и давлении 2 МПа в присутствии катализаторов стеарата магния (C17H35COO)2Mg или нафтената кобальта (С6Н11СОО)2Со. При окислении образуется смесь циклогексанола и циклогексанона в соотношении 4:1с суммарным выходом смеси до 75%:
С6Н12 + 0,5О2 = С6Н11ОН + Q
С6Н12 + О2 = С6Н10О + Q
Чтобы избежать развития реакций глубокого окисления с распадом цикла степень конверсии циклогексана не должна превышать 0,1 дол. единиц.
3. Дегидрирование циклогексанола до циклогексанона протекает при нормальном давлении и температуре 360-400 оС в присутствии цинк-хромового катализатора или при температуре 260-300 оС в присутствии медь-магниевого катализатора:
С6Н11ОН «С6Н10О + Н2 - Q
Выход циклогексанона в процессе достигает 95% при степени конверсии циклогексанола 0,7—0,8 дол. единиц.
6.2. Физико-химические основы и технологическая схема стадий оксимирования и изомеризации циклогексаноноксима
4. Оксимирование циклогексанона до циклогексаноноксима протекает в избытке водного раствора сульфата гидроксиламина и в присутствии аммиака или щелочи при температуре от 0 °С до 100 °С
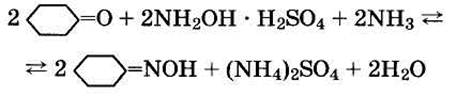
Реакция оксимирования обратима. Равновесие ее сдвигается в сторону образования оксима при понижении кислотности среды, то есть при связывании выделяющейся кислоты щелочным реагентом. Реакция протекает в гетерогенной системе, в диффузионной области и, поэтому, ускоряется путем интенсивного перемешивания реагентов. Чтобы избежать побочных реакций конденсации циклогексанона оксимирование проводится в две стадии. Сначала процесс ведется в избытке циклогексанона, а затем, в избытке гидроксиламина. Выход циклогексаноноксима в этих условиях приближается к 100%.
5. Изомеризация циклогексаноноксима в капролактам (Бекмановская перегруппировка) протекает в присутствии концентрированной (98%-ной) серной кислоты или 20% -ного олеума при температуре 125 оС:
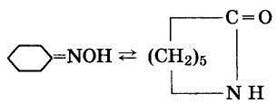
Реакция перегруппировки протекает по ионному механизму через образование катиона с зарядом на атоме азота и может быть представлена так:
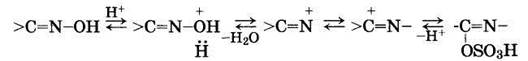
По окончании изомеризации серная кислота нейтрализуется при охлаждении водным раствором аммиака или гидроксида натрия. При этом образовавшийся сульфат енольной формы капролактама превращается в капролактам:
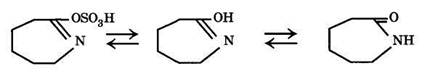
Технологическая схема стадий оксиминирования и изомеризации циклогексаноноксима в производстве капролактама из бензола представлена на рис. 14.12.
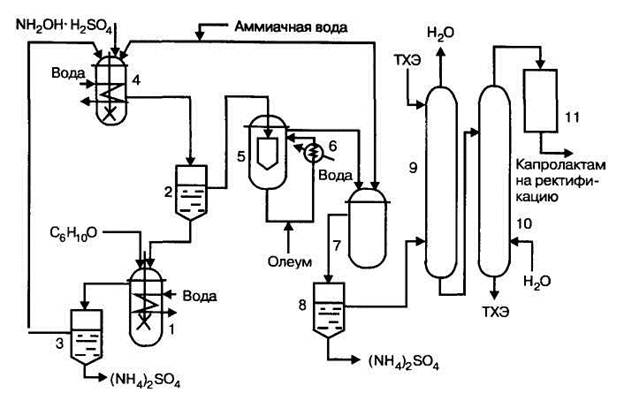
Рис. 14.12. Технологическая схема стадий оксимирования и изомеризации (перегруппировки) в производстве капролактама из бензола: 1 - реактор оксимирования I ступени, 2,3,8- сепараторы, 4- реактор оксимирования II ступени, 5 - реактор перегруппировки, 6— выносной холодильник, 7 - нейтрализатор, 9 - экстрактор, 10 - реэкстрактор, 11 - блок очистки капролактама.
В реактор первой ступени оксимирования 1подаются циклогексанон и раствор сульфата гидроксиламина в водн ом сульфате аммония после второй стадии оксиминирования из сепаратора 2. Продукты реакции разделяются в сепараторе 3 на водный слой — раствор сульфата аммония и органический слой - раствор оксима в циклогексаноне. Органический слой поступает в реактор оксиминирования второй ступени 4, в который также подается свежий раствор сульфата гидроксиламина и аммиачная вода. Реакционная смесь, почти не содержащая циклогексанона, направляется в сепаратор 2, в котором разделяется на водно-сульфатный слой, содержащий не вступивший в реакцию гидроксиламин, и сырой циклогексаноноксим. Водный слой подается в реактор 1, а циклогексаноноксим поступает на стадию перегруппировки в реактор 5. Для съема реакционного тепла смесь в нем циркулирует через выносной холодильник 6, а олеум вводится в циркулирующую холодную смесь. Продукты перегруппировки из реактора 5 поступают в нейтрализатор 7, куда подается аммиачная вода. Нейтрализованная масса из нейтрализатора поступает в сепаратор 8, в котором водный раствор сульфата аммония отделяется от «лактамного масла», содержащего 60—65% мае. капролактама, 30—35% мае. воды и примеси сульфата аммония и побочных продуктов. Для получения капролактама высокой степени чистоты лактамное масло подвергается очистке в две стадии. На первой стадии капролактам экстрагируется из масла в экстракторе 9трихлорэтиленом. Полученный экстракт поступает в реэкстрактор 10, вкотором капролактам растворяется в воде и отделяется от трихлорэтиленового слоя, содержащего примеси. Водный раствор капролактама из верхней части реэкстрактора направляется на вторую стадию очистки в блок очистки 11, где он очищается с помощью ионообменных смол и гидрированием на катализаторе. Очищенный раствор капролактама упаривается и ректифицируется в вакууме.
Выход капролактама по циклогексанону составляет 90— 95%. Мощность современных установок по производству капролактама колеблется от 90 до 130 тыс. тонн в год. Дальнейшее использование капролактама зависит от организации производства поликапролактама. Если цех полимеризации расположен на территории предприятия, капролактам транспортируется в него в виде расплава по обогреваемому трубопроводу. В ином случае капролактам подвергается кристаллизации и выпускается в виде твердого продукта.
 2014-02-24
2014-02-24 19301
19301