Окислительно – восстановительными называются такие химические реакции, которые протекают с изменением степеней окисления атомов элементов.
Согласно электронной теории в таких химических реакциях происходит перераспределение электронов от одних атомов, молекул или ионов к другим.
Сущность этой теории сводится к следующим основным положениям:
1. Окислением называется процесс отдачи атомом, молекулой или ионом электронов. При этом происходит повышение степени окисления: S+4 - 2e ®S+6
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. При этом происходит понижение степени окисления S+4 +4e ®S0
3. Восстановителями называются атомы, молекулы или ионы, отдающие электроны. Во время реакции они окисляются.
4. Окислителями называются атомы, молекулы или ионы, присоединяющие электроны. Во время реакции они восстанавливаются.
5. В окислительно – восстановительных реакциях число электронов отдаваемых восстановителями, равно числу электронов, принимаемых окислителями.
6. В реакциях, где число электронов, отдаваемых восстановителем и число электронов принимаемых окислителем являются четными при нахождении коэффициентов число электронов делят на общий наибольший делитель.
7. Если числа электронов, отдаваемых восстановителем и принимаемых окислителем нечетные, а в результате реакции должно получиться четное число атомов, то коэффициенты удваиваются.
8. Важнейшими окислителями являются:
а) положительные ионы металлов с высокой степенью окисления: Sn4+, Pb4+, Fe3+
б) молекулы, содержащие атомы металла в состоянии высшей степени окисления: KMn+7O4, K2Cr2+6 O7, HAu+3CI4
в) молекулы, содержащие атомы неметаллов в положительной степени окисления: HN+5O3, H2S+6O4, HCI+5O3
9. Важнейшими восстановителями являются:
а) нейтральные атомы активных металлов (I,IIAгр), а также Н2, С, СО;
б) положительные ионы металлов в низшей степени окисления: Pb2+, Sn2+, Fe2+, Cu2+, Cr2+, Mn2+
в) отрицательные ионы неметаллов: S2-, J-, Br-.
10. Молекулы, содержащие атомы металлов и неметаллов в промежуточной степени окисления могут быть окислителями и восстановителями в зависимости от того с какими веществами они взаимодействуют:
+4 0 - +6
H2SO3 + Br2 + H2O = 2НBr + H2SO4
 Восстановитель S+4 – 2e ® S+6 1 пр.окисления
Восстановитель S+4 – 2e ® S+6 1 пр.окисления
Окислитель Br0 + 1e ® Br- 2 пр.восстановления
H2SO3 +2H2S-2 ®3S0 + 3H2O
 Окислитель S+4 +4e ® S0 2 1 пр.восстановления
Окислитель S+4 +4e ® S0 2 1 пр.восстановления
Bосстановитель S-2 – 2e ® S0 4 2 пр.окисления
Существуют следующие типы окислительно–восстановительных реакций:
1.реакции самоокисления – самовосстановления (диспропорционирования)
4KCI+5O3 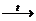 3KCI+7O4 + KCI-1
3KCI+7O4 + KCI-1
 Bосстановитель CI+5 – 2e ®CI+7 6 3 пр.окисления
Bосстановитель CI+5 – 2e ®CI+7 6 3 пр.окисления
Окислитель CI+5 + 6e® CI-1 2 1 пр.восстановления
2. Реакции внутримолекулярного окисления–восстановления:
2KCI+5O3-2 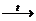 2KCI-1 + O20
2KCI-1 + O20
 Окислитель CI+5 + 6e® CI-1 4 2 пр.восстановления
Окислитель CI+5 + 6e® CI-1 4 2 пр.восстановления
Bосстановитель 2O-2 – 4e ®O20 6 3 пр.окисления
3. Реакция межмолекулярного окисления–восстановления:
2KMnO4 + 5KMNO2 + 3H2SO4 = 2MnSO4 + 5KNO3+K2SO4+H2O
 Окислитель Mn+7 + 5e ® Mn+2 2 пр.восстановления
Окислитель Mn+7 + 5e ® Mn+2 2 пр.восстановления
Bосстановитель N+3 – 2e ® N+5 5 пр.окисления
В рассмотренных примерах мы использовали метод электронного баланса. В основе его лежит правило о том, что число электронов, отданных восстановителем равняется числу электронов присоединенных окислителем.
Сущность этого метода можно проследить на примере составления уравнения реакции взаимодействия меди с концентрированной азотной кислотой. Для этого прежде всего необходимо написать схему реакции из формул исходных и полученных веществ и указать над символами участвующих в реакции элементов их степень окисления.
+5 +2 +4
Cu0 + HNO3 ® Cu(NO3)2 + NO2 + H2O
Как видно из этого уравнения валентность меди возросла с 0 до +2, а у азота она понизилась с +5 до +4. Здесь атом меди отдал два электрона и является восстановителем, а атом пятивалентного азота принял 1 электрон и служит окислителем.
Теперь нужно составить электронные уравнения и найти коэффициенты, уравнивающие число отданных и принятых электронов:
 Cu – 2e ® Cu+2 1
Cu – 2e ® Cu+2 1
N+5 + e ® N+4 2
Из приведенных электронных уравнений видно, что коэффициент для восстановителя (Си) равен 1, а для окислителя (N) равен –2. Отсюда схема реакции примет вид:
Cu + 2HNO3 ® Cu(NO3)2 + 2NO2 + H2O
Теперь необходимо учесть, что помимо участия в образовании оксида азота две молекулы азотной кислоты необходимые для связывания образовавшихся ионов Си2+ в нитрат меди. Поэтому коэффициент перед HNO3 необходимо увеличить до 4 и соответственно поставить коэффициент 2 перед водой (Н2О). После этого можно написать уравнение реакции в окончательном виде, заменив стрелку знаком равенства.
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + H2O
Порядок расстановки коэффициентов в уравнениях окислительно–восстановительных реакций по методу электронного баланса:
1.Определяем атомы каких элементов изменили степень окисления в результате реакции.
2. Определяем восстановитель и окислитель и составляем уравнение электронного баланса реакции.
3. Учитывая, что электронный обмен является эквивалентным, определяем по правилам нахождения наименьшего кратного общее число перемещающихся электронов.
4. Ставим дополнительные множители к окислителю, восстановителю, окисленной и восстановленной формам.
5. Уравниваем металлы, которые не изменили степени окисления.
6. Уравниваем кислотные остатки.
7. Уравниваем водород.
8. Проверяем правильность уравнивания по кислороду.
Пример:
2HNO3 + 3Na2SO3 = 2NO + 3Na2SO4 + H2O
 Окислитель N+5 + 3e = N+2 2 пр.восстановления
Окислитель N+5 + 3e = N+2 2 пр.восстановления
Восстановитель S+4 – 2e = S+6 3 пр.окисления
Признаком правильности подбора коэффициентов является одинаковое количество атомов каждого элемента в обеих частях уравнения.
Окислительно–восстановительные реакции имеют большое значение в производственных процессах: при сгорании топлива, при электролизе, в процессах коррозии металлов, в основе металлургических процессов получения металлов из руд. С их помощью получают аммиак, щелочи, кислоты и другие ценные химические продукты.
Благодаря окислительно–восстановительным реакциям происходит превращение химической энергии в электрическую в химических источниках тока гальванических элементах и аккумуляторах.
Не меньшую роль играют эти реакции в биологических процессах (фотосинтез, дыхание, обмен веществ).
СТРОЕНИЕ АТОМА
Вопреки существующему мнению, что атом является наименьшей частицей вещества, пределом делимости материи, Бутлеров А.М. в 1886 году высказал гениальную научную мысль: " Атомы не неделимы по своей природе, а неделимы только доступными нам средствами и сохраняются лишь в тех химических процессах, которые известны теперь, но могут быть разделены в новых процессах, которые будут открыты впоследствии".
К началу ХХ столетия было накоплено много фактического материала, который свидетельствовал о сложности структуры атома.
Изучение катодных лучей привело к открытию электрона. Заряд электрона был условно принят за – 1. Масса электрона составляет 1/1836 массы самого легкого элемента водорода, поэтому масса электрона (mе) принята равной 0. ( ).
).
Электронейтральнoсть свободных (несвязанных) атомов указывает, что в них должно содержаться одинаковое число положительных и отрицательных единиц электричества.
При потере атомом водорода электрона образуется частица, несущая единичный положительный заряд. Она получила название протона. Заряд протона равен по величине и противоположен по знаку заряду электрона, а масса – наименьшая из всех ядер.  .
.
В 1932 году Д.Чедвик при изучении ядерных реакций открыл нейтральную частицу с массой почти равной массе протона, которая была названа нейтроном  .
.
Советский ученый Иваненко Д.Д. и немецкий ученый Гейдзенберг независимо друг от друга разработали протонно – нейтронную теорию ядра, согласно которой ядра атомов состоят из протонов и нейтронов.
Массовое число ядра (атомная масса) равно сумме протонов и нейтронов.

.
Атомы одного и того же элемента, имеющие один и тот же заряд ядра, но различные атомные массы, называются изотопами: 


Ядра изотопов одного и того же элемента имеют одинаковое число протонов (заряд ядра), но различное число нейтронов.
В соответствии с понятиями квантовой механики состояние электрона в атоме может быть описана с помощью 4 –х квантовых чисел:
n – главное квантовое число;
l – орбитальное, побочное (азимутальное) квантовое число;
ml – магнитное квантовое число;
ms - спиновое квантовое число.
n – главное квантовое число определяет энергию электрона и размеры электронных облаков, т.е. отражает удаление электрона от ядра атома. Чем ближе к ядру находится электрон, тем меньше его энергия.
Поэтому n определяет номер энергетического уровня на котором находится данный электрон.
Количество энергетических уровней в атоме соответствует номеру периода в котором находится атом данного элемента в таблице Д.И.Менделеева.
n имеет значения 1, 2, 3, 4, 5, 6,7
обозначение энергетического уровня K,L,M,N,O,P,Q
При значении n = 1 электрон находится на первом энергетическом уровне и т.д.
Максимальное число электронов на том или ином энергетическом уровне вычисляют по формуле: 
Эта формула справедлива только до 4 – го уровня включительно.
Тогда на 1 – м уровне содержится 2 электрона,
2 – м 8 электронов
3 – м 18 электронов
4 – м 32 электрона.
Кроме того, установлено, что во внешнем слое атомов не может размещаться более 8 электронов, а на предпоследнем – более 18.
l – орбитальное квантовое число.
Немецким физиком А.Зоммерфельдом было доказано, что электроны движутся вокруг ядра не только по круговым, но и по эллиптическим орбитам различной вытянутости.
Энергия электронов с различной формой электронного облака даже в пределах одного энергетического уровня различна.
Поэтому энергетические уровни делятся на подуровни. Каждому подуровню соответствует определенная форма электронного облака.
Таким образом орбитальное квантовое число характеризует энергетическое состояние электрона в подуровне и форму электронного облака.
1 может иметь значения от 0 до (n -1), т.е. всего n значений. Номер энергетического уровня определяет количество подуровней. Подуровни обычно обозначаются буквами: s, p, d, f, q, h при значениях орбитальных квантовых чисел 1=0, 1, 2, 3, 4, 5.
Это начальные буквы английских названий серий спектральных линий атомных спектров:
s – sharp – резкая,
p – principal – главная,
d – diffuse – диффузная (размытая) и т.д.
Т.О. в соответствии с существующей терминологией электроны, охарактеризованные значением
1 = 0 принято называть s – электронами;
1 = 1 –"– –"– –"– р – электронами;
1 = 2 –"– –"– –"– d – электронами;
1 = 3 –"– –"– –"– f – электронами.
Следовательно, каждому значению главного квантового числа n в многоэлектронном атоме соответствует несколько электронных орбит разной энергии (или разных подуровней энергии)
| n – главное квантовое число | 1– Орбитальное квантовое число | Число подуровней | Обозначение подуровней в уровне |
| 1s | |||
| 0,1 | 2s, 2р | ||
| 0, 1, 2 | 3s, 3р, 3d | ||
| 0, 1, 2, 3 | 4s, 4р, 4d, 4f |
Максимальное число электронов в подуровне определяют по формуле: Ne = 2(2×1 + 1).
Подставляя вместо "1" численные значения побочного квантового числа, находят максимально возможное число электронов в подуровне:
s – подуровне может быть 2(2×0 + 1) = 2 электрона;
р – подуровне – " – 2(2×1 + 1) = 6 электронов;
d – подуровне – " – 2(2×2 + 1) = 10 электронов;
f – подуровне – " – 2(2×3 + 1) = 14 электронов.
mе – магнитное квантовое число
Движущийся по замкнутым линиям электрон создает магнитное поле, взаимодействие которого с внешним магнитным полем определяет пространственное расположение электронной орбиты в атоме, что связано с изменением энергии электрона.
Таким образом магнитное квантовое число (mе) характеризует зависимость энергетического состояния электрона от положения плоскости его орбиты в пространстве. То есть в пределах одного подуровня возможна еще более тонкая градация в энергетических состояниях: подуровни имеют энергетические орбитали.
Атомная электронная орбиталь это часть электронного облака, где вероятность нахождения электрона составляет более 90%. Она характеризуется определенными значениями квантовых чисел n, 1, mе, т.е. определенными размерами, формой и ориентацией в пространстве электронного облака.
Условно орбиталь обозначается в виде ячейки (прямоугольника) или черточки, стрелка – электрон
 |
¯ ¯
mе принимает значения от 0 до ± 1, всего (2×1 + 1) значений. Из этого следует, что каждому значению побочного квантового числа "1" соответствует (2×1 + 1) электронных орбит, которые различаются пространственным расположением в атоме, например:
| Орбитальное квантовое число,1 | Магнитное квантовое число, m | Число орбиталей (ячеек) с данными 1 |
| 1 (s – орбиталь) | ||
| -1, 0, +1 | 3 (р – орбитали) | |
| -2, -1, 0, +1, +2 | 5 (- орбиталей) | |
| -3, -2, -1, 0, +1, +2, +3 | 7(f – орбиталей) |
Общее число орбиталей на уровне определяется по формуле:

 т.е на 1 – м уровне 1 орбиталь 1s
т.е на 1 – м уровне 1 орбиталь 1s

|
2s
 |
на 3 – м уровне 9 орбиталей
|
 2018-01-21
2018-01-21 1681
1681
