Основу электрохимических процессов составляют ионные и окислительно-восстановительные реакции в растворах и расплавах электролитов. Поэтому для лучшего восприятия, понимания и усвоения материала лекций о сущности электрохимических процессов следует обязательно повторить изученные ранее темы: «Растворы электролитов», «Ионные реакции в растворах электролитов», «Окислительно-восстановительные реакции».
Повторяя тему «Окислительно-восстановительные реакции» обратите внимание на то, что в ходе таких реакций имеет место перемещение электронов от одних атомов к другим, что является предпосылкой для возникновения электрического тока. Найдите ответы на вопросы:
- какой процесс называется окислением, какой восстановлением;
- какой атом является окислителем, какой восстановителем.
? │ Zn0 → Zn2+ + 2e │ процесс?
? │ 2Ag+ + 2e → 2Ag │ процесс?
Вместо вопросительных знаков напишите название процессов (окисление, восстановление) и определите окислитель и восстановитель.
В ходе изучения нового материала по теме: «Электрохимия» прежде всего необходимо усвоить основные понятия, которыми оперирует этот раздел химии.
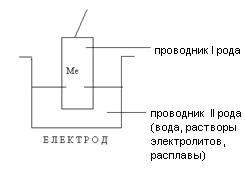
1. Электрод - это система, состоящая из проводника I рода (металл, графит и т.п.), погруженного в проводник II рода (раствор или расплав электролита).
2. Электродный процесс - это процесс, происходящий на границе раздела проводник I рода – проводник II рода.
3. Анод – электрод, на котором происходит процесс окисления (отдача электронов).
4.Катод – электрод, на котором происходит процесс восстановления (присоединение электронов).
5. Электродный потенциал – это энергия, которая выделяется или поглощается в ходе электродного процесса (φ, В)
Ме0 → Меn+ + ne, φок. Процесс окисления
Men+ + ne → Me0, φвосст. Процесс восстановления
φвосст., Me0 ↔ Меn+ + ne, φок.
φвосст. = - φок.
Если электродные процессы происходят при стандартных условиях, то потенциалы называются стандартными (φ0, В)
Стандартные условия:
Т= 298 К; Р = 1,01∙ 105Па; СМ = 1моль/л

Таблица значений стандартных электродных потенциалов восстановления (Меn+ / Me0) позволяет определить:
1. Сравнительную электрохимическую активность металлов: чем меньше значение потенциалов восстановления иона, тем активнее металл.
2. Способность металлов вытеснять другие металлы из растворов их солей: каждый предыдущий металл вытесняет все последующие металлы из растворов их солей:
Cu + ZnSO4 → Zn + CuSO4 → ZnSO4 + Cu
3. Способность металлов вытеснять водород из кислот –неокислителей (HBr, HCl, HI, H2SO4 (разб.)): если значение потенциала меньше нуля (то есть отрицательное), то вытесняет.
Fe + 2HCl → FeCl2 + H2 Ag + HCl →
φ0 Fe2+ / Fe0 = - 0,44B φ0 Ag+ / Ag0 = 0,794B
Значения электродных потенциалов зависят от температуры, давления (для газовых систем) и от концентрации электролита. Зависимость выражена в уравнении Нернста (В. Нернст, 1864-1941,немец)
φ = φ0 + RT ∕ nF ∙ ln [Men+],
где φ- электродный потенциал при условиях отличающихся от стандартных
φ0 - стандартный электродный потенциал
R - универсальная газовая постоянная
T - абсолютная температура
n - число электронов, участвующих в электронном процессе
F - число Фарадея
ln [Men+] - натуральный логарифм концентрации ионов металла в электролите.
Для расчета потенциалов при условиях, отличающихся от стандартных лишь концентрацией электролита, используют приведенное уравнение Нернста
φ = φ0 + 0,059 ∕ n ∙ lg [Men+]
Значение электродного потенциала является главным критерием в определении анода и катода, а следовательно и направления протекания окислительно-восстановительных реакций в электрохимических процессах.
Гальванические элементы называют химическими источниками электрического тока. Электрический ток – это направленное движение заряженных частиц: электронов или ионов. Такое движение возникает в проводнике под действием электродвижущей силы. Электродвижущая сила возникает если между положительным и отрицательным полюсами проводника существует разность потенциалов (справочник по физике. Раздел «Электрический ток»)
это устройства, состоящие из двух электродов которые имеют разные потенциалы и соединены внешним и внутренним проводниками в замкнутую систему внешний проводник
 внутренний проводник
внутренний проводник
φ0Fe2+ / Fe0 = - 0,44B φ0Ag+ / Ag0 = + 0,799B
Рисунок №1
Анодом в подобных системах будет тот электрод, который имеет меньшее значение потенциала восстановления катиона металла (φ Меn+ / Ме0, В) (см. таблицу электродных потенциалов).
На аноде происходит процесс окисления Ме0 → Меn+ + ne
Катионы Меn+ переходят в раствор электролита (см. рис 1). Электроны (ne), оставаясь в металле анода, придают ему отрицательный заряд.
Вследствие наличия разности потенциалов анода и катода, во внешнем проводнике возникает электродвижущая сила (ЭДС). Под действием ЭДС электроны движутся от анода к катоду, создавая во внешнем проводнике электрический ток.
На катоде идет процесс восстановления. На границе раздела металл / электролит, то есть Ме0 / Меn+ электроны, «пришедшие» от анода соединяются с катионами металла электролита Men+ + ne → Me0
Атомы металла оседают на поверхности катода.
Анионы кислотных остатков из катодного электролита по внутреннему проводнику перемещаются в анодный электролит, где компенсирует катионы металла анода (см. рис.1). Роль внутреннего проводника могут выполнять ионно-желатиновый мостик, влажная бумага или ткань и т.п..
Для описания физико-химической сущности гальванических процессов необязательно использовать громоздкий рисунок (рис 1). Достаточно написать соответствующую схему и химизм реакции.

φ0Fe2+∕ Fe0 = - 0,44B φ0Ag+∕ Ag0 = + 0,799B
А) Fe0 →2e + Fe2+ K) 2AgNO3 → 2Ag+ +2NO3-;
2Ag+ +2e → 2Ag0
Fe0 + 2Ag+ → 2Ag0 + Fe2+
Fe0 + 2 AgNO3 → 2Ag0 + Fe(NO3)2
Будьте внимательны при составлении электронных уравнений анодного и катодного процессов: число электронов отданных должно быть равно числу электронов принятых. Равенство достигается путем расстановки коэффициентов (в случаи необходимости).
ЭДС гальванического элемента по сути есть разность потенциалов двух электродов. И поскольку величина ЭДС всегда положительная, то рассчитать ее можно по формуле: ЭДС = φ0К - φ0A; т.к. φ0К > φ0A ЭДС = φ0Ag+∕ Ag0 - φ0Fe2+∕ Fe0 = 0,799 – (-0,44) = 1,239 В
Для лучшего запоминания сущности процессов, происходящих на электродах используйте мнемоническое правило: на а ноде идет о кисление, сопровождающеся о тдачей электронов. Знак анода о трицателен – все определяющие слова начинаются на гласную букву.
На к атоде идет в осстановление, сопровождающееся п рисоединением электронов. Знак катода п оложительный – все определяющие слова начинаются на согласную букву.
Для определения области использования того или иного гальванического элемента следует знать, что они бывают: а) необратимые; б) обратимые
Необратимые гальванические элементы – это устройства, которые после выработки ресурса не подлежат восстановлению. Пример: элемент Лекланше и разнообразные современные его модификации (батарейки Mars, Philips, Sony)
Элемент Лекланше
- A Zn │ NH4Cl │ MnO2 (C) K +
A) Zn0 + 2 NH4Cl = Zn(NH3)2Cl2 + 2H+
K) 2 MnO2 + 2H+ = Mn2O3 + H2O
Zn + 2 NH4Cl + 2 MnO2 = Zn(NH3)2Cl2 + Mn2O3 + H2O
ЭДС = 1,5 – 1,8 В.
Обратимые гальванические элементы могут быть использованы многократно после повторной зарядки. Зарядка осуществляется пропусканием через элемент постоянного электрического тока.
Такие химические источники тока называются аккумуляторами. В зависимости от состава электролита аккумуляторы бывают кислотные и щелочные.
 2018-01-21
2018-01-21 2542
2542
