Химическая реакция – это химическое явление, при котором происходят химические превращения одних веществ в другие.
Например, при нагревании смеси простых веществ серы (S) и железа (Fe) образуется новое химическое соединение сульфид железа (FeS). Происходит химическая реакция:
Fe + S = FeS
По признаку изменения числа исходных и конечных веществ (продуктов реакции) известны следующие типы реакций: соединения, разложения, замещения и обмена.
Реакции соединения – это такие химические реакции, при которых из двух или нескольких веществ получается одно новое вещество:
H2 + S = H2S; 3MgO + P2O5 = MG3(PO4)2
Реакции разложения – это такие химические реакции, при которых из одного вещества получается два или несколько новых веществ:
СаСО3 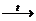 СаО + СО2; 2КС1О3
СаО + СО2; 2КС1О3 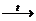 2КС1 + 3О2
2КС1 + 3О2
Реакции замещения – это реакции, при которых атомы простого вещества замещают атомы одного из элементов сложного вещества:
2NaBr + CI2 = 2NaCI + Br2; CuSO4 + Fe = FeSO4 + Cu
Реакции обмена – это реакции при которых два сложных вещества обмениваются своими сложными частями:
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3;
AI2O3 + 3H2SO4 = AI2(SO4)3 + 3H2O
Если в основу классификации реакций, положить изменение степени окисления элементов, то можно отметить еще реакции идущие без изменения степени окисления, например:
Са(ОН)2 + 2НС1 = СаС12 + 2Н2О
и реакции, происходящие с изменением степеней окисления (окислительно–восстановительные реакции):
+2 -3 +2 -3
3CuO + 2NH3 = 3Cu0 + N20 + 3H2O; 3Ca0 + 2P0 = Ca3P2
В зависимости от направления протекания различают обратимые и необратимые химические реакции.
Если реакция происходит одновременно в обоих направлениях, то это обратимая реакция:
СО + С12 Û СОС12; 3H2 + N2 Û 2NH3
А если продуктом реакции является газ, осадок или слабый электролит, то это необратимая реакция:
2КС1О3 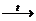 KCI + 3O2; AgNO3 + HCI = AgCI¯ + HNO3;
KCI + 3O2; AgNO3 + HCI = AgCI¯ + HNO3;
K2CO3 + 2HCI = 2KCI + H2O + CO2
В зависимости от значения теплового эффекта химической реакции могут реакции быть экзотермическими и эндотермическими. Реакции, которые сопровождаются выделением теплоты, называются экзотермическими: С + О2 = СО2; DН= -393кДж (DН < 0).
называются эндотермическими
; DН = 90,4 кДж; (DН > 0)
В зависимости от агрегатного состояния участвующих в реакции веществ, реакции могут быть гомогенными и гетерогенными. В гомогенных реакциях участвующие в реакции вещества находятся в одинаковом агрегатном состоянии (газообразном или жидком):
Н2(Г) + С12(Г) = 2НС1(Г); 2СО(Г) + О2(Г) = 2СО2(Г)
Н3РО4(Ж) + 3ЛОН(Ж) = К3РО4(Ж) + 3Н2О(Ж)
В гетерогенных реакциях участвующие в реакции вещества находятся в разных агрегатных состояниях и реакции происходят на границе раздела фаз:
С(Т) + О2(Г) = СО2(Г)
СаО(Т) + СО2(Г) = СаСО3(Т)
2Fe(T) + 3CI2(*) = 2FeCI3(T)
 2018-01-21
2018-01-21 760
760








