Идеальный газ – это газ, молекулы которого не имеют объёма, отсутствуют силы межмолекулярного притяжения и ассоциация молекул. Идеальный газ – это научная абстракция. В природе идеальных газов нет. Но при малых давлениях, не превышающих 3 МПа, и температурах, далеких от абсолютного нуля, любой газ можно условно считать идеальным и применять к нему уравнение состояния идеального газа. Чем больше превышение давления газа над 3 МПа и чем ниже его температура, тем больше газпо свойствам отличается от идеального газа и тем выше погрешность, даваемая уравнением Менделеева-Клайперона.
Для расчета процессов природного газа низкого, среднего и высокого давления, используемого для промышленных и бытовых нужд, вполне применимо уравнение состояния Менделеева- Клайперона
Уравнение состояния идеального газа может записываться в различных формах:
pv = RT
pvμ = RμT
pW = MRT
 p = ρRT
p = ρRT
|
Здесь, p-абсолютное давление в Па;v -удельный объем в  ;Т -абсолютная термодинамическая температура в градусах Кельвина;R - удельная газовая постоянная в Дж/(кг*К);
;Т -абсолютная термодинамическая температура в градусах Кельвина;R - удельная газовая постоянная в Дж/(кг*К);  - универсальная газовая постоянная;vμ – молярный объём;
- универсальная газовая постоянная;vμ – молярный объём;
|
|
|
μ -молярная масса;M-масса системы в кг; W-объем системы в м3; N- число киломолей вещества системы;ρ=1/v - плотность в кг/ м3
Удельная газовая постоянная R является индивидуальной характеристикой газа и берется из справочной литературы или вычисляется через универсальную газовую постоянную имолярную массу μ:
R =  , , 
|
Так для воздуха μ = 28,96 и тогда R= 8314/28,96= 287 
Удельныйи молярный объемы связаны между собой соотношением

Киломоль – это количество вещества в килограммах, численно равное его молекулярной массе. Из этого определения число киломолей вещества системы равно
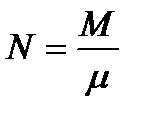
Например, для28,96 кг сухого воздуха смолярной массойµ = 28,96число киломолейN=1.
Уравнение состояния выполняется в любом из термодинамических процессов, совершаемых газом. Частными случаями уравнения состояния, когда один из термодинамических параметров ( p, T или v ) поддерживается постоянными, являются уравнения изопроцессов: изобарного ( RT/v=Const), изотермического(PV=Const) или изохорного (RT/P=Const).
 2018-01-21
2018-01-21 879
879








