При высоких давлениях и очень низких температурах использовать уравнение Менделеева-Клапейрона нельзя и следует использовать уравнения состояния реального газа.
Известно много уравнений состояния реального газа, каждое из которых имеет свою область применения. Наиболее теоретически обоснованными являются уравнения состояния реального газа в виде ряда с вириальными коэффициентами:

|
Здесь, B 0, B 1, B2, B 3, … - вириальные коэффициенты, определяемые опытным путём. На практике ограничиваются первыми тремя вириальными коэффициентами.Уравнение имеет и другие формы записи.
Впервые уравнение состояния реального газа было получено в 1887 году голландцем Ван-дер-Ваальсом:

|
Здесь, b – это поправка на собственный объём молекул (коволюм),  - поправка на силу межмолекулярного взаимодействия (внутреннее давление).
- поправка на силу межмолекулярного взаимодействия (внутреннее давление).
Ассоциация молекул – объединение двух и более молекул в группы. Уравнение Ван-дер-Ваальса не учитывает ассоциации молекул, но оно впервые позволило полностью описать термодинамические процессы с фазовыми переходами, например, сжижение газа при его изотермическом сжатии. Для идеального газа изотермический процесс записывается в виде уравнения pv = const, которое в pv – координатах изображается как гипербола первого порядка (рис.3)
|
|
|

Рисунок Изотермическое сжатие идеального газа
Но, как показывают многочисленные опыты, реальный процесс изотермического сжижения газасущественно отличается от картины изотермическое сжатия идеального газа.
P
| Жидкость (однофазное состояние) |
| Жидкость+пар (двухфазное состояние) |
| Газ (однофазное состояние) |
| область применения уравнения Менделеева-Клапейрона |
V
Рисунок. Изотермическое сжижение реального газа при его сжатии.
Обозначения: - - - --расчет по уравнению Ван-дер-Ваальса; - опыт.
В целом, уравнение Ван-дер-Ваальса качественно правильно и удовлетворительно количественно описывает процессы реального газа.
Заштрихованные области -это области метастабильного,то есть крайне неустойчивого состояния вещества, которые трудно обнаружить в обычных опытах.
При высоких температурах поправка на межмолекулярное взаимодействие мала, и ею можно пренебречь. Для расчета процессов в стволах артиллерийского и стрелкового оружия, где давление может изменяться от 30 до 700 МПа, а температура газов- от 500 до 3000°K, используется уравнение Дюпре:
|
|
|

|
где, 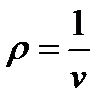 - плотность, α – коволюм.
- плотность, α – коволюм.
Уравнение Дюпре –это частный случай уравненияВан-дер-Ваальса (1.34) при внутреннем давлении ( )=0.
)=0.
Для практических расчётов используют уравнение Майера-Боголюбова:
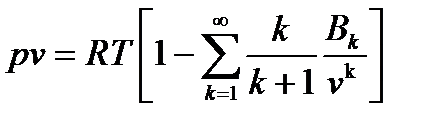 ,
,
Здесь, B k – k -тый вириальный коэффициент. Как показали опыты, для реального газа под разряжением достаточно взять k =1, тогда уравнение Майера-Боголюбоваприобретает простой вид:
 ,
,
Для расчёта процессов с водяным паром широко используется уравнение Вукаловича-Новикова:
 ,
,
Здесь A и B – эмпирические коэффициенты.
Известны и другие уравнения состояния реального газа. Все рассмотренные выше уравнения по сути являются частными случаями уравненияв виде ряда с вириальными коэффициентами.
В практике инженерных расчетоввместо громоздких уравнений состояния реального газа часто используютсязаменяющие их таблицы и диаграммы. Так для расчета процессов водяного пара используются энтальпийно-энтропийные (I-S) диаграммыи таблицы насышенного и перегретого пара. Аналогичные таблицы и диаграммы составлены и для других веществ: аммиака, фреонов, углекислого газа и т.д.
 2018-01-21
2018-01-21 1032
1032
