Из рассмотрения различных вариантов «сопряжения», то есть сочетанияизменяющихсянезависимым образом термодинамических параметровтермодеформационной системы можно получить следующие характеристические функции:
 - свободная энтальпия, Дж.
- свободная энтальпия, Дж.
F= U – TS – удельная свободная энергия (энергия Гельмгольца, изохорно-изотермический потенциал), 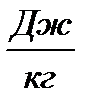 ;
;
U -удельная внутренняя энергия, 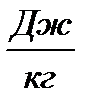 ;
;
Ф= U – TS + pv -удельная свободная энтальпия (энтальпия Гиббса, изобарно-изотермический потенциал), 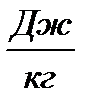
i= U + pv – удельная энтальпия («теплосодержание»), 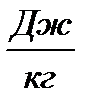 .
.
Все характеристические функции ( F,U,Ф,i ) являются функциями состояния:
ΔU = U2 – U1
ΔФ = Ф2 – Ф1
ΔF = F2 – F1
Δi = i2 – i1
(К функциям состояния относится также энтропия S, не являющаяся характеристической функцией).
Длядифференциаловхарактеристических функций можно получитьочень важные соотношения 6
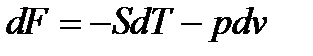
|
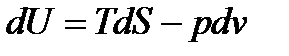
|
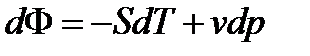
|
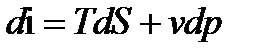
|
Формулы для дифференциалов характеристических функций – это различные формы записи первого начала термодинамики для термодеформационной системы.
|
|
|
Так, уравнение dU=TdS – pdv после подстановки в него зависимостей
TdS = dQ и PdV = dA,
приобретает вид первого начала термодинамики в обычнойдифференциальной форме
dU = dQ – dA.
Втеплотехнических расчетах понятие «удельная энтальпия» используется очень широко.
В исходной формуле дляудельной энтальпии:
| i = U + pv |
U- удельная внутренняя энергия, которая у идеального газа зависит только от его температуры, а произведение pv имеет физический смысл потенциальной энергии 1кг газа при данном давлении p и удельном объёме v.
Из соотношения di = TdS+vdp, используя известные соотношения для теплоты(TdS = dQ) и полезной работы (dAпол= -VdP),
получим di = dQ -dA пол
или
| dQ = di + dA пол |
Полученное уравнение называют первым началом термодинамики в дифференциальной энтальпийной форме. После его интегрирования получим выражение для первого начала термодинамики в интегральной энтальпийной форме
| Q = ∆i + Aпол |
Формулировка первого начала термодинамики в энтальпийной форме:
т еплота, подведенная к системе, идет на увеличении ее энтальпии и на совершение системой полезной работы.
Получим двасоотношения, очень полезные для теплотехнических расчетов.
1. Из di = TdS+vdp для изобарного процесса(dP=0)получим
dQp =dip,
| Qp =i2 – i1 |
илипосле интегрирования:
Таким образом, в изобарных процессах количество теплоты, которой обмениваются система и окружающая среда, равно разности значений энтальпий в конечном и начальном состояниях системы.
2. Изпервого начала термодинамики в дифференциальной энтальпийной форме dQ = di + dA пол для адиабатного (dQ=0) процесса получим
|
|
|
dis = -dA пол
илипосле интегрирования:
| А пол = -∆is = i1 – i2 |
Таким образом, полезная работа в адиабатных процессах равна разности энтальпий в начальном и конечном состояниях системы.
 2018-01-21
2018-01-21 858
858








