Так как теплоёмкость зависит от вида процесса, то необходимаформула для теплоёмкости в политропном процессе сn.
Из общей формулы для теплоёмкостей однородных систем
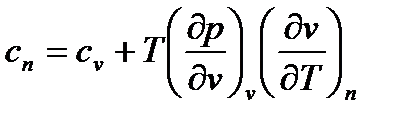 ;
;
при 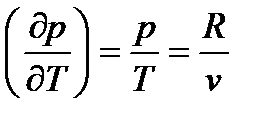 и
и 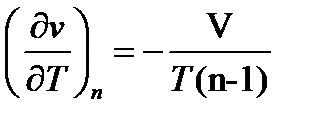
можно получить формулу для массовой (удельной) теплоёмкости в политропном процессе:
 |
Показатель адиабаты k всегда больше единицы, в то время как показатель политропы n может иметь значения от (-¥) до (+¥).
Если n<k, но больше единицы,то значение теплоемкости cn получаетсяотрицательным.
Отрицательнаятеплоемкость не может быть объясненас физической точки зрения и носит формальный характер, поэтомудальнейшие вычисления работы А,и теплотыQ и внутренней энергииUвыполняются с этим отрицательным значением.
Так как уравнениеполитропы  применяется для описания всего множества термодинамических процессов, то изопроцессыможно рассматривать как частные случаи политропного процесса. Такиз уравнения
применяется для описания всего множества термодинамических процессов, то изопроцессыможно рассматривать как частные случаи политропного процесса. Такиз уравнения 
при n = 0 получается уравнение изобарного процесса(p=const);
при n = 1 – уравнение изотермического процесса(pv=const);
при n = k – уравнение адиабатного процесса (pvk=const);
При n = ±¥ уравнение политропного процесса превращается в уравнение изохорного процесса(v=const).

n<0
На данном рисунке представлены различные термодинамические процессы с указанием соответствующих значений показателя политропы. Пунктирной линией в качестве примера изображены процессы, не относящиеся к изопроцессам.
| n>k |
 2018-01-21
2018-01-21 2536
2536
