Приборы и реактивы:
• электрическая плитка;
• коническая колба для получения коллоидного раствора;
• растворы для получения золей: 2% FeCl3
• дистиллированная вода;
• диализатор;
• раствор AgN03 для проведения качественной реакции на хлорид-ионы;
• три бюретки, заполненные растворами 4,0 моль-экв/л NaCl, 0,01 моль-экв/л Na2S04, 0,001 моль-экв/л K3[Fe(CN)6]
Золь гидроксида железа (III) получают гидролизом хлорида железа (III):
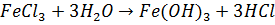
Обработка результатов эксперимента
| Электролит-коагулятор | 4,0 моль-экв/л NaCl | 0,01 моль-экв/л Na2SO4 | 0,001 моль-экв/л K3[Fe(CN)6] |
| Исходная концентрация электролита C1, моль-экв/л | 4,0 | 0,01 | 0,001 |
| Объём электролита, вызвавшего коагуляцию золя V1, мл | 8,4 | 1,2 | |
| Объём электролита V2, пересчитанный на коонцентрацию 0,001 моль-экв/л, мл | |||

| 4,526 | 1,079 | 1,107 |
| Валентность иона-коагулятора, z | |||
Порог коагуляции, 
| 3.36 | 0.0012 | 0,003 |
Строим график зависимости объёма электролита, вызвавшего коагуляцию lgV2,от валентности иона-коагулятора:

Определяем отношения порогов коагуляции при различных значениях валентности ионов-коагуляторов:
 (NaCl):
(NaCl):  (Na2SO4):
(Na2SO4):  (K3[Fe(CN)6])=15,733:6,6:1
(K3[Fe(CN)6])=15,733:6,6:1
Вывод:
1. В результате эксперимента получен золь гидроксида железа (III) путём гидролиза хлорида железа (III). Ионами-коагуляторами для золя гидроксида железа (III) являются анионы электролитов, так как коллоидный раствор имеет положительно заряженные коллоидные частицы.
2. Были извлечены низкомолекулярные примеси (чужеродные электролиты), способные разрушать коллоидные системы методом диализа из золи гидроксида железа (III).
3. Диализ помог извлечь из золи гидроксида железа (III) низкомолекулярные примеси.
4. Из построенной зависимости видно, что с увеличением валентности ионов-коагуляторов уменьшается порог коагуляции, что подтверждает правило Шульца-Гарди.
 2018-01-21
2018-01-21 479
479







