Ионные реакции обмена в растворах электролитов:
В обменных реакциях, протекающих в растворах электролитов, наряду с недиссоциированными молекулами слабых электролитов, твердыми веществами и газами участвуют также находящиеся в растворе ионы. Поэтому сущность протекающих процессов наиболее полно выражается при записи их в форме ионно-молекулярных уравнений. Например, уравнения реакций нейтрализации сильных кислот щелочами:
HClO4 + NaOH →NaClO4 + H2O,
2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O,
выражаются одним и тем же ионно-молекулярным уравнением:
H+ + OH– → H2O,
из которого следует, что сущность этих процессов сводится к образованию из ионов водорода и гидроксид-ионов малодиссоциированного электролита – воды. Аналогично уравнения реакций
BaCl2 +H2SO4 → BaSO4↓ + 2HCl,
Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3
выражают один и тот же процесс образования из ионов Ва2+ и SO42— осадка малорастворимого электролита – сульфата бария:
Ва2+ + SO42– → BaSO4↓.
На основании рассмотренных примеров можно сделать следующий вывод: реакции в растворах электролитов всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ.
|
|
|
Реакции в растворах электролитов идут до конца, если в результате взаимодействия веществ происходит образование осадка, выделение газа и образование слабого электролита.
Взаимодействие кислой соли и щелочи приводит к образованию средней соли и воды.
При взаимодействии основной соли и кислоты образуется средняя соль и вода.
Амфотерные гидроксиды [Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3 и др.] растворяются в растворах щелочей с образованием комплексных солей.
Правило Бертолле:
Протекание аналитических реакций в растворах подчиняется правилам Бертолле. Предложенные правила Бертолле обычно формулируются следующим образом.
Если смешать две соли АВ и DE, то начавшаяся реакция обменного разложения скоро останавливается, в растворе оказываются четыре соли АВ, DE, АЕ и BD, составляющие равновесную систему:
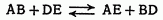
Этот случай наблюдается, если исходные и образующиеся соли растворимы в воде. Если же хотя бы одно из веществ нерастворимо и, выделяясь в виде газа или в виде осадка, выходит из сферы реакции, то реакция идет до конца в сторону образования этого вещества, т. е. пока не будет исчерпан весь материал для его образования.
На самом деле вещества, образующиеся в процессе реакции, не выходят из сферы реакции, как предполагал Бертолле, так как все реакции в той или иной мере обратимы:
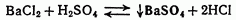
Разрушение комплексов и растворение осадков:
Разрушение комплексов будет происходить, когда лигандов соединения будет не достаточно. И если ввести вещества, с которыми лиганды соединяться более прочно, чем с комплексом.
|
|
|
Условия растворения осадков - Для растворения какого-либо осадка необходимо связать один из посылаемых им в раствор ионов другим ионом, который образовал бы с ним малодиссоциирующее соединение.
 2018-01-21
2018-01-21 1528
1528
