Электрохимические процессы:
Химические превращения, происходящие при воздействии электрического тока на вещества, называются электролитическими.
Электролитические процессы классифицируются следующим образом:
· получение неорганических веществ (водорода, кислорода, хлора, щелочей и т.д.)
· получение металлов (литий, натрий, калий, бериллий, магний, цинк, алюминий, медь и т.д.)
· очистка металлов (медь, серебро и т. д.)
· получение металлических сплавов
· получение гальванических покрытий
· обработка поверхностей металлов (азотирование, борирование, электрополировка, очистка)
· получение органических веществ
· электродиализ и обессоливание воды
· нанесение пленок при помощи электрофореза
Электродный потенциал:
Электродныйпотенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом ираствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличииполярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
|
|
|
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Число Фарадея:
ПостояннаяФарадея — физическая постоянная, определяющая соотношение между электрохимическими и физическими свойствами вещества.
Постоянная Фарадея равна  Кл·моль−1.
Кл·моль−1.
Постоянная Фарадея входит в качестве константы во второй закон Фарадея (закон электролиза).
Численно постоянная Фарадея равна электрическому заряду электронов, при прохождении которых через электролит на электроде выделяется (1/z) моль вещества A в формуле:

где: 
 — количество электронов, участвующих в ходе реакции.
— количество электронов, участвующих в ходе реакции.
Для постоянной Фарадея  справедливо следующее соотношение:
справедливо следующее соотношение:
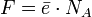 ,
,
где  — элементарный заряд, а
— элементарный заряд, а  — число Авогадро.
— число Авогадро.
Уравнение Нернста:
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
|
|
|
 ,
,
где
·  — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
·  — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
·  — абсолютная температура;
— абсолютная температура;
·  — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
·  — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
·  и
и  — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант  и
и  и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при  получим
получим

Водородный электрод:
Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используютплатину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н+ + 2e− = H2
то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.
ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
Ряд напряжений:
Ряд напряжений (реже — ряд активностей) - последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный Водородный электрод. Поэтому в Р. н. включают и водород, электродный потенциал которого принимается равным нулю.
 2018-01-21
2018-01-21 1483
1483
