Вольт-эквивалент:
Вольт-эквивалент (ВЭ)= n E – это изменение энергии Гиббса процесса переноса электрона между двумя соседними ионами: A3+ + e = A2+.
Диаграммы Латимера:
Диаграммы Латимера обобщают данные об окислительно-восстановительных свойствах соединений элементов. Поскольку значения потенциалов зависят от кислотности растворов, диаграммы Латимера составляют отдельно для сильно кислых (рН 0) и сильно щелочных (рН 14) растворов. Записывают в порядке уменьшения степеней окисления формулы тех соединений, в виде которых элемент существует в водном растворе. Для каждого из переходов указывают значения стандартных окислительно-восстановительных потенциалов.
Диаграммы Фроста:
Рассмотрим принцип построения диаграммы Фроста для марганца:
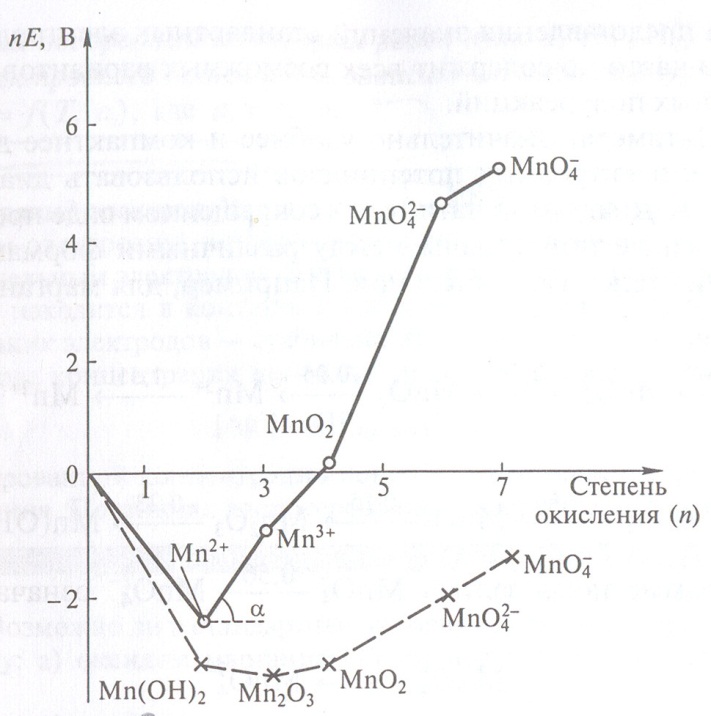
Диаграмма Фроста для марганца: о – при рН 0; х – при рН 14.
1. Начало координат соответствует условию: nE = 0 для пары
Mn2+/ Mn0 при n = 0.
2. Для получения координат других точек на диаграмме Фроста стандартный электродный потенциал сопряженной пары «окислитель – восстановитель», в которой восстановленной формой является состояние со степенью окисления ноль, умножают на степень окисления окисленной формы. Например, для Mn2+ значение вольт-эквивалента равно:
|
|
|
ВЭ(Mn2+/ Mn0) =n x E0 (Mn2+/ Mn0) = -1.18 x 2= -2.36В.
а для MnO2 – ВЭ= 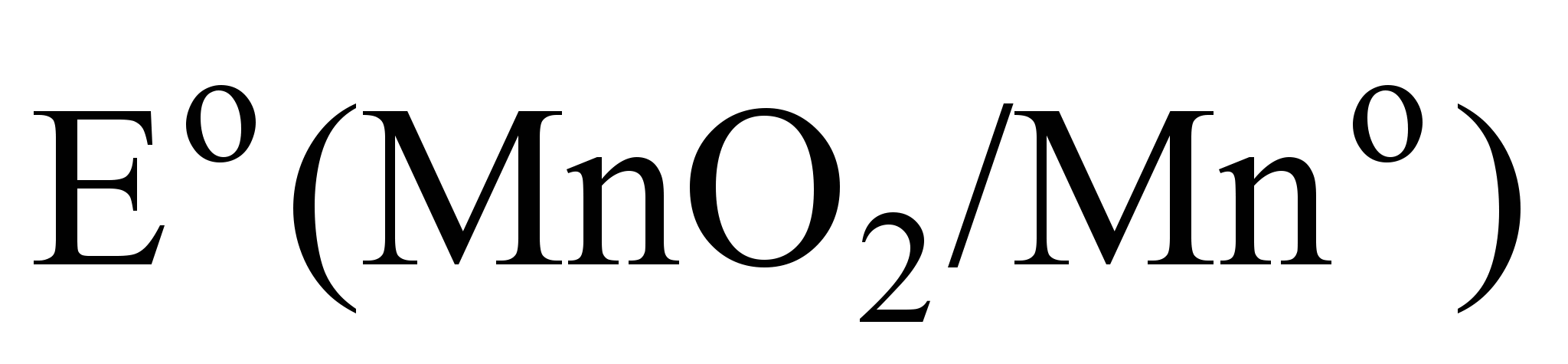 х4 =0.025х 4 =0.10 В.
х4 =0.025х 4 =0.10 В.
Диаграмма Фроста позволяет:
· Сопоставить окислительную способность различных ионов:
Mn3+/ Mn2+ и Mn4+/ Mn2+.
На диаграмме окислительных состояний наклон линий (tga) равен стандартному электродному потенциалу соответствующей сопряженной окислительно-восстановительной пары. Так, в данном случае tga1 = 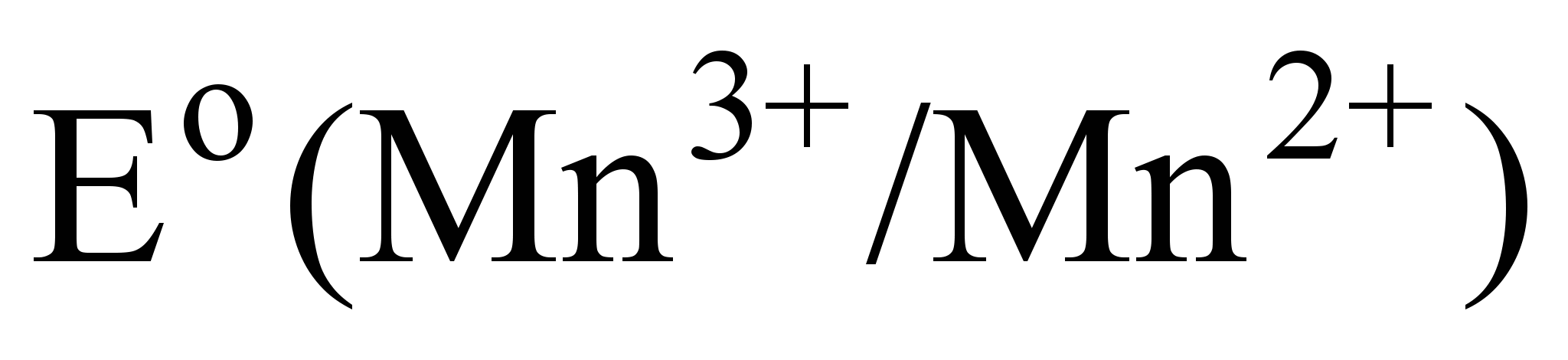 больше, чем tga2 = E0 (Mn4+/ Mn2+). Поэтому по отношению к Mn2+ ион Mn3+ оказывается более сильным окислителем, чем MnO2 .
больше, чем tga2 = E0 (Mn4+/ Mn2+). Поэтому по отношению к Mn2+ ион Mn3+ оказывается более сильным окислителем, чем MnO2 .
· Можно определить наиболее устойчивую степень окисления элемента при данной кислотности среды. Ей отвечает минимум на кривой. Для марганца в кислой среде такой формой является Mn+2. Действительно, при восстановлении всех форм марганца в кислой среде и окислении Mno образуются соединения Mn+2. В щелочной же среде наиболее устойчивой формой является Mn2O3. При контакте с кислородом воздуха Mn(OH)2 легко окисляется, образуя Mn2О3.
· Можно определить формы, неустойчивые по отношению к процессам диспропорционирования. Если координата точки, соответствующей данному окислительному состоянию, находится выше линии, соединяющей любые соседние точки (рис. 4б), то эта форма диспропорционирует. Поясним это на примере реакции диспропорционарования K2MnO4 в кислой среде:
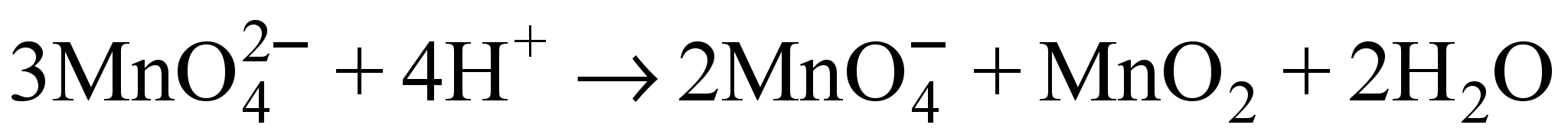
Если 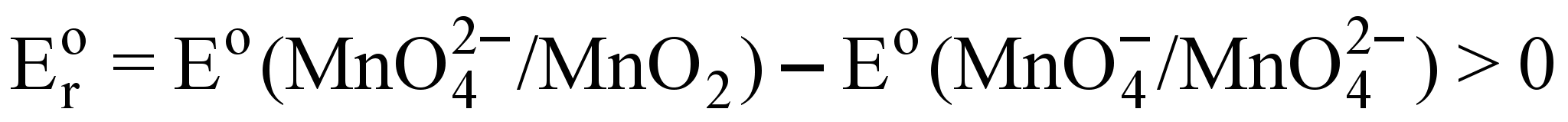 , то эта реакция возможна. В данном случае Ео(
, то эта реакция возможна. В данном случае Ео(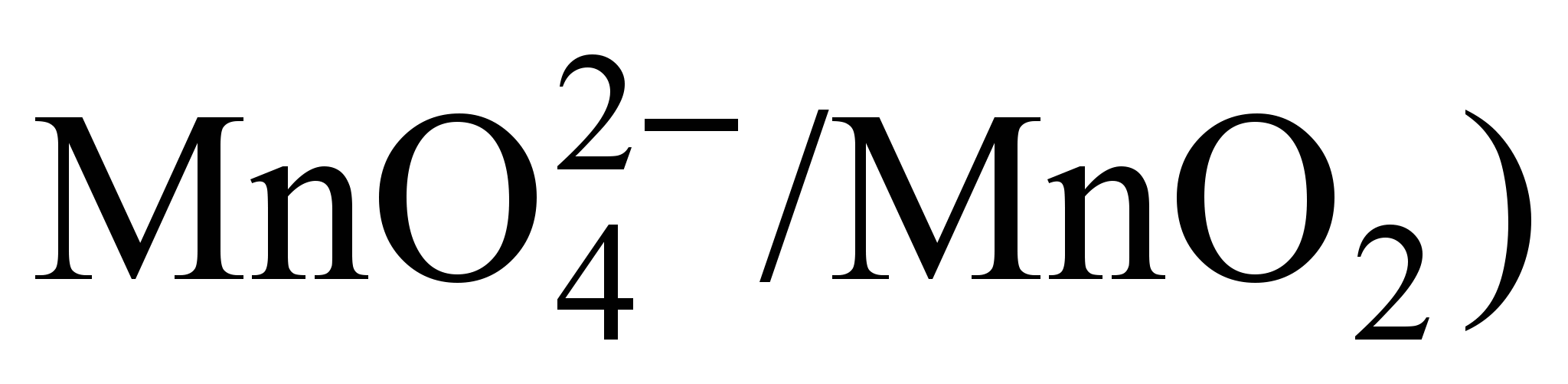 >Ео(
>Ео(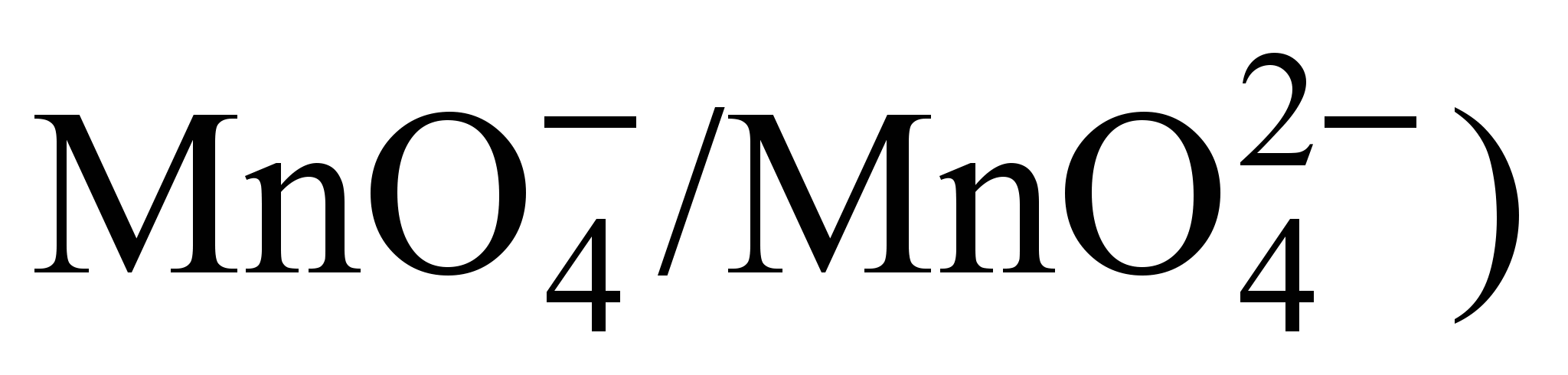 – наклон линии
– наклон линии 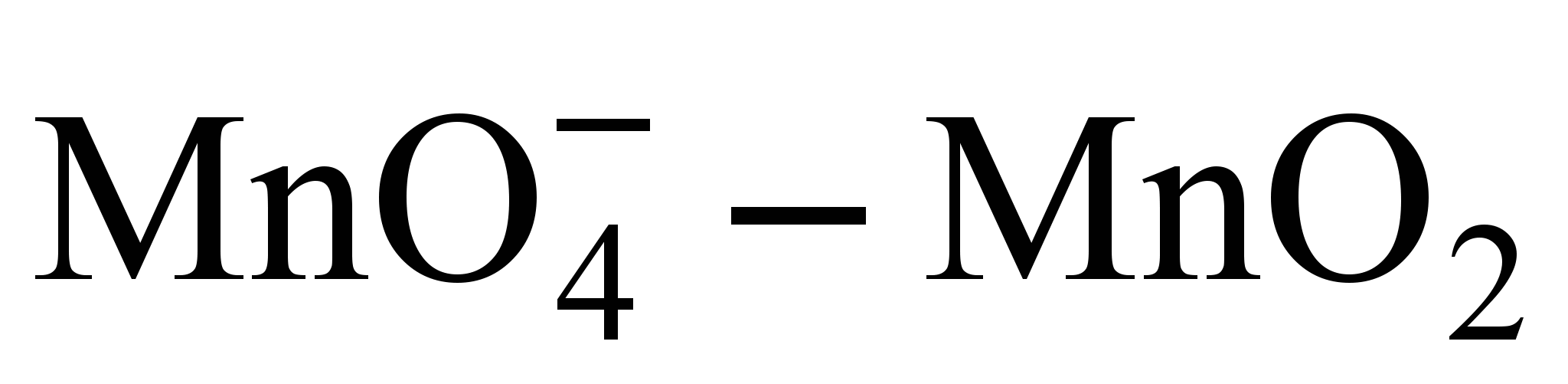 превышает наклон линии (
превышает наклон линии (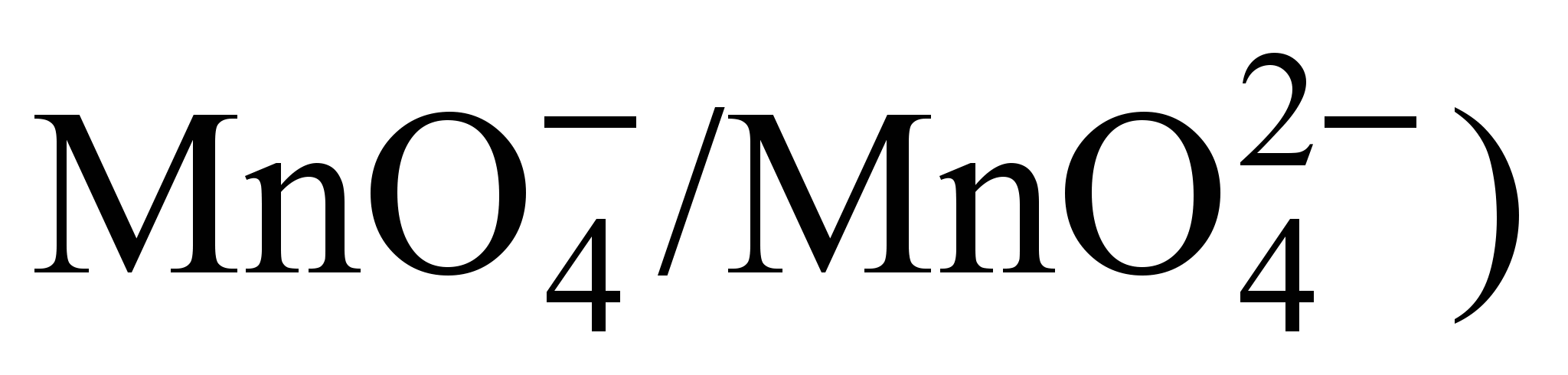 , и, следовательно,
, и, следовательно,  > 0:
> 0:
|
|
|
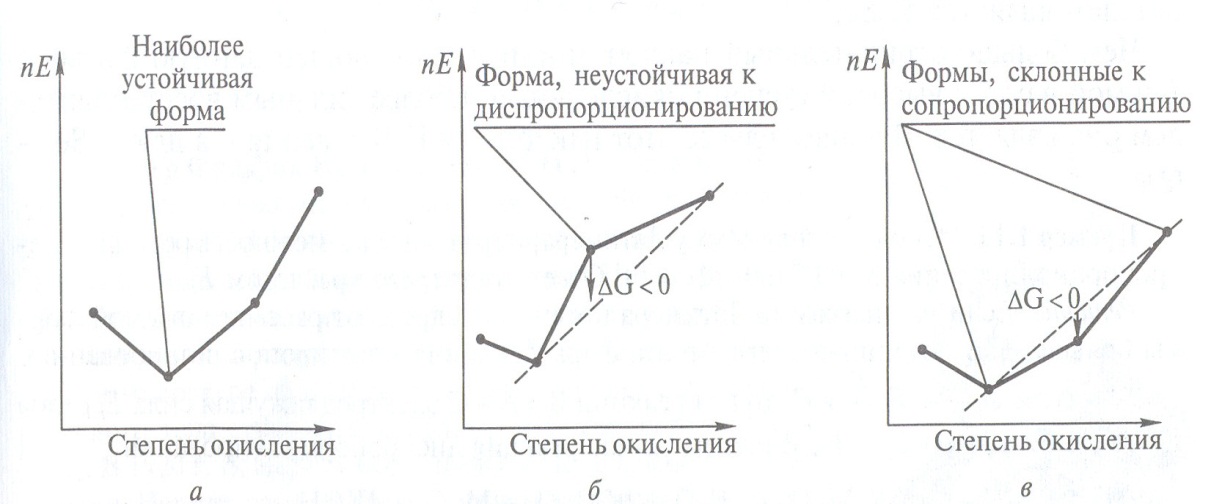
Схемы диаграмм Фроста, иллюстрирующие наиболеестабильные окислительные формы: (а), склонные к реакциидиспропорционирования (б), склонные креакциям сопропорционировнаия (в)
Сопоставление окислительно-восстановительных свойств и устойчивости соединений элементов в разных степенях окисления:
Сопоставление окислительно-восстановительных свойств можно осуществить по отношению стандартных электродных потенциалов.
Сопоставление устойчивости можно определить по минимальному значению стандартного электродного потенциала для данного соединения при данной кислотности среды.
 2018-01-21
2018-01-21 7560
7560
